Parmi les modèles alimentaires controversés et clivants, la diète cétogène figure probablement dans le haut de la liste. Initialement mise au point dans les années 1920 pour améliorer la prise en charge des enfants épileptiques, elle tombe par la suite en désuétude durant la périodes des guerres mondiales. Le régime cétogène revient cependant sur le devant de la scène au sein de la population générale à la fin du 20ème siècle, notamment dans les pays anglophones.
A l’heure actuelle, les partisans (plus ou moins objectifs) de la diète cétogène vont jusqu’à affirmer que celle-ci permettrait de traiter les troubles métaboliques comme l’obésité, le diabète ou encore la résistance à l’insuline, en réduisant notamment l’inflammation de bas grade. Pour certains, elle serait également pertinente ou prometteuse dans la prise en charge du cancer et des maladies neuro-dégénératives, considérées par certains chercheurs comme une forme de diabète de type 3 (1)(2). A l’inverse, on entend parfois dans la bouche de certains professionnels que la diète cétogène serait dangereuse, potentiellement à l’origine de nombreuses carences alimentaires et de divers déséquilibres hormonaux.
Autant dire qu’en ce qui concerne la diète cétogène, on entend (une fois n’est pas coutume) tout et son contraire.
L’objectif de cet article est donc de répondre à la question suivante : la diète cétogène est-elle pertinente pour les personnes souhaitant perdre du poids ou victimes de troubles métaboliques ? Nous tenterons également de voir si elle est adaptée et efficace pour tout le monde ou si au contraire son efficacité dépend de certains paramètres individuels ?
Bonne lecture à tous 😊
1. Qu’est ce que le régime cétogène ?
Le régime cétogène, à l’instar des jeunes prolongés, a pour objectif principal de modifier en profondeur le métabolisme et le fonctionnement énergétique du corps.
D’ordinaire, le corps dispose de différents types de « carburants » pour produire de l’énergie et permettre le bon fonctionnement des différents systèmes. Au quotidien, il utilise un mélange de lipides et de glucides qu’il puise respectivement dans les triglycérides (les réserves de tissu adipeux contenus dans le corps) et le(s) glycogène(s) musculaire et hépatique (le glucose stocké par le corps). En situations de restriction calorique extrême comme des jeunes prolongés ou des efforts physiques très longs, les protéines peuvent aussi être utilisées comme source d’énergie. L’utilisation préférentielle des glucides ou des lipides par le corps va dépendre du contexte de l’individu : efforts physiques et/ou cognitifs plus ou moins intenses, réserves de l’organisme à un instant t, le genre de la personne ou encore certains facteurs génétiques. A titre indicatif, après le jeune nocturne le corps consommerait environ 40-45% de son énergie via les lipides contre 35-40% pour les glucides (3).
Pour autant, le glucose constitue en général le carburant préférentiel des cellules pour assurer la production d’énergie au quotidien. C’est notamment le cas pour le cerveau, qui s’avère être un très gros consommateur d’énergie (jusqu’à 20% de l’énergie quotidienne, et 20-30% également pour le foie), particulièrement friand de glucose pour fonctionner correctement !
Au niveau nutritionnel, le régime cétogène a pour objectif de réduire drastiquement la consommation de glucides via l’alimentation afin d’engendrer la production par le foie de molécules très particulières que l’on appelle les corps cétoniques. Ces corps cétoniques sont produits dans les mitochondries des cellules à partir d’une molécule que l’on appelle l’Acétyl-CoA (cf. schéma ci-dessous). Parmi ces corps cétoniques, on retrouve l’acétone, l’acétoacétate et le β-hydroxybutyrate (BHB), probablement le plus important des 3 compte tenu de ses nombreux effets potentiels sur le corps. Nous y reviendrons plus tard. Pour entrer en état de cétose et ainsi augmenter significativement la production de corps cétoniques, on considère généralement qu’il convient de manger moins de 50gr de glucides/jour (4)(5). Pour autant, cette valeur de 50gr/jour n’est en aucun cas universelle et peut significativement varier d’un individu à l’autre et ce en fonction de plusieurs paramètres (âge, genre, sensibilité à l’insuline, activité métabolique etc..). Une personne consommant 80gr de glucides par jour pourra ainsi entrer en état de cétose alors qu’une autre n’en consommant que 40gr pourrait à l’inverse ne pas y arriver. Pour rappel, un état de cétose se définit en termes physiologiques par une concentration sanguine en BHB supérieure à 0.5mmol/L (6). Dans les urines, une personne en cétose verra la concentration d’acétoacétate augmenter au-delà de 0.5mmol/L. Il semblerait pour autant que les mesures sanguines de BHB soient plus fiables et représentatives que les mesures urinaires (6)(7).
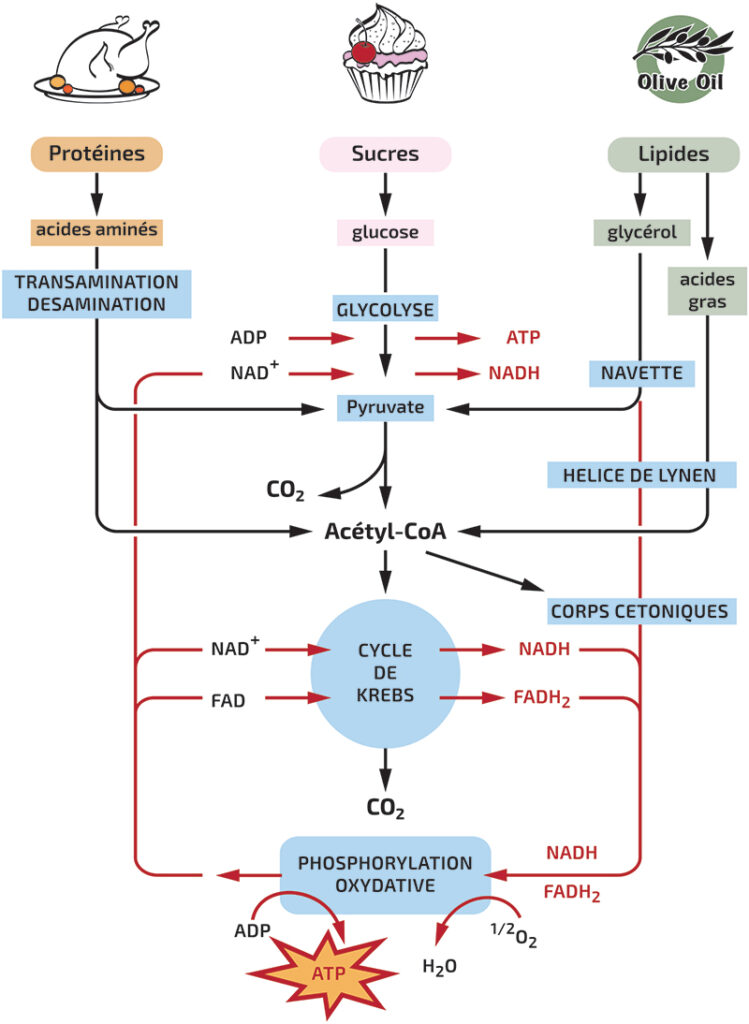
Figure 1 : Le métabolisme énergétique et la production de corps cétoniques
2. Les intérêts de l’alimentation cétogène
A ce niveau de l’article, vous vous dites peut-être : « C’est bien beau tout ça, mais quel intérêt de se priver d’autant de glucides ? Qu’est ce qu’ils ont de si particulier, ces corps cétoniques ? ».
Et bien il faut tout d’abord savoir que ces corps cétoniques possèdent un rôle capital en situation de privation calorique/glucidique importante car, lors de ces situations, le cerveau ne peut pas utiliser les acides gras provenant du tissu adipeux. En effet, ces derniers ne sont que difficilement capables de passer la barrière hémato-encéphalique et ne peuvent ainsi pas correctement approvisionner le cerveau en énergie (8). Les corps cétoniques peuvent donc constituer une source d’énergie de remplacement dans des situations spécifiques. Pendant longtemps, il fut par ailleurs supposé que l’intérêt des corps cétoniques ne se situait que dans la production d’énergie. On sait désormais qu’il en va autrement.
En effet, le β-hydroxybutyrate possède par exemple de nombreuses propriétés physiologiques que les chercheurs commencent simplement à découvrir.
a) Corps cétoniques et régulation de l’appétit
En premier lieu, les corps cétoniques sont désormais reconnus comme étant capables de réduire significativement les sensations de faim (9). La consommation d’une boisson à base de cétones a ainsi démontré à plusieurs reprises (10)(11) sa capacité à faire baisser la production de ghréline, l’une des hormones responsables de la sensation de faim et produite majoritairement par l’estomac. Mais l’impact des corps cétoniques sur l’appétit ne s’arrête pas là ; en effet, il se pourrait que la production de corps cétoniques soit associée à une augmentation de la production de certains peptides responsables de la sensation de satiété (12). Parmi ces peptides, on retrouve notamment le fameux GLP-1 (glucagon-like peptide 1), la cholécystokinine (CKK) ou encore le peptide YY. En pratique, cette réduction de l’appétit et cette modification de la production des hormones gastro-intestinales se traduit dans plusieurs études par une réduction spontanée de l’apport énergétique. Dans une 1ère étude datant de 2008 (13), 20 hommes en situation d’obésité étaient assignés de manière randomisée à une diète et ce pendant 4 semaines. Durant les 4 premières semaines, ils consommaient ainsi soit une diète cétogène riche en protéines (30% protéines, 4% glucides et 66% lipides) soit une diète équivalente en termes de calories et de protéines mais plus riche en glucides (30% protéines, 35% glucides et 35% lipides). A l’issue de l’étude, il s’est avéré que la diète cétogène induisait un apport énergétique inférieur à la diète normale de l’ordre d’environ 200kcal/jour, avec une diminution concomitante des sensations de faim. La diète cétogène a également engendré une perte de poids supérieure à l’issue des 4 semaines, -6.34kg contre -4.35kg pour la diète classique. Ces résultats semblent confirmés par une autre étude (14) datant de 2024 et cette fois conduite sur 6 mois. Les sujets étaient pour le coup au nombre de 80, la encore en situation d’obésité. 41 personnes suivaient ainsi une diète cétogène hypocalorique ne contenant pas plus de 50gr de glucides/jour, la ou les 39 autres suivaient une alimentation hypocalorique également mais avec un apport de glucides plus important. De façon intéressante, la majorité des acides gras apportés par l’alimentation cétogène étaient des acides gras insaturés, limitant ainsi l’apport en acides gras saturés et trans. De même, l’apport en fibres était maintenu entre 20 et 30gr/jour, c’est-à-dire à hauteur des recommandations officielles en la matière. Résultats des courses : à l’issue des 6 mois, la perte de poids atteinte était bien plus importante dans le groupe cétogène (-7.8 ± 5.2 kg) que dans le groupe contrôle (4.2 ± 5.6 kg, p = 0.01). Qui plus est, la diète cétogène s’est avérée plus efficace pour faire baisser les valeurs d’hémoglobine glyquée et de pression artérielle, sans pour autant engendrer d’augmentation du LDL-cholestérol. En ce qui concerne la régulation des sensations de faim et de l’appétit, il semblerait donc que la diète cétogène soit bel et bien un outil efficace, comme le montre une méta-analyse effectuée sur le sujet (15). Pour autant, la production de corps cétoniques semble également en mesure de réduire l’activité du système nerveux sympathique et, par conséquent, la dépense énergétique totale (16)(17).
b) Corps cétoniques et inflammation
En ce qui concerne l’inflammation, la encore on entend beaucoup de choses circuler à propos de la diète cétogène. Celle-ci posséderait en effet des vertus anti-inflammatoires voir même anticancer pour certains. Voyons voir ce que disent les études à ce sujet.
Tout d’abord, il semblerait que les corps cétoniques puissent exercer une action aussi bien anti-inflammatoire que pro-inflammatoire, dépendant des contextes considérés. Il convient donc de ne pas être trop tranché sur la question et de garder un point de vue nuancé. Sur des modèles cellulaires humains et animaux, l’acétoacétate semble en effet plutôt exercer une action pro-inflammatoire (18)(19), encore une fois dépendant du contexte considéré et notamment des concentrations sanguines/urinaire d’acétoacétate.
Pour ce qui est du BHB, les effets sur l’inflammation semblent plutôt bénéfiques. En effet, de nombreux auteurs rapportent que le BHB aurait tendance à inhiber une voie inflammatoire majeure, connue sous le nom de voie NLRP3 inflammasome (20)(21)(22). Cette voie inflammatoire est reconnue comme étant impliquée dans de nombreux pathologies inflammatoires chroniques comme les maladies neuro-dégénératives (23) ou encore les maladies auto-immunes (24)(25). L’inhibition de cette voie engendrée par le BHB permettrait notamment de réduire la production de cytokines pro-inflammatoires comme l’interleukine-6 (IL-6), l’IL-1β, le TNF-α ou encore l’IL-18 (26)(27) bien que les preuves directes de cette affirmation sur des modèles humains soient encore limitées.
Pour ce qui est des études effectuées chez l’humain, une méta-analyse (28) de 2025 regroupant 44 essais randomisés (RCT) met en évidence une réduction plus importante de 2 cytokines pro-inflammatoires (TNF-α (WMD: -0.32 pg/mL; 95% CI: -0.55, -0.09; P = 0.007) et IL-6 (WMD: -0.27 pg/mL; 95% CI: -0.52, -0.02; P = 0.036)) grâce à la diète cétogène que via une alimentation normale. Ces réductions étaient d’autant plus importantes lorsque les études étaient prolongées plus de 8 semaines ainsi que chez les personnes ayant un IMC supérieur à 30. Pour autant, aucune différences n’ont été constatées en ce qui concerne la protéine C réactive (CRP). La CRP étant l’un des marqueurs inflammatoires les plus utilisés lors des tests de routine, voyons ce que disent les études à ce sujet.
A ce niveau, on retrouve une autre méta-analyse de 2025 regroupant 5 RCT (29) et qui met en évidence une meilleure réduction des valeurs de CRP (-0.62 mg/dL (95% CI: -0.84, -0,40) grâce à la diète cétogène qu’en comparaison à une alimentation « normale ». Pour autant, une autre étude (30) parue en 2019 et conduite sur 17 hommes en situation de surpoids suggère l’inverse ; dans cette étude, une alimentation cétogène de 4 semaines (15% protéines, 5% glucides, 80% lipides) était comparée à une alimentation isocalorique « classique » (15% protéines, 50% glucides, 35% lipides). En dépit d’une meilleure sensibilité à l’insuline et de triglycérides abaissés, la diète cétogène a eu pour effet d’augmenter les valeurs de cholestérol et de CRP.
Bien que la diète cétogène puisse être bénéfique en matière de gestion de l’inflammation chronique/de bas grade, les données ne semblent pour l’heure pas aussi prometteuses que celles observées sur des modèles animaux/cellulaires. De plus, peu d’éléments nous permettent d’affirmer la supériorité de la diète cétogène en matière de gestion de l’inflammation en comparaison avec une alimentation « normale » et apportant le même nombre de calories.
c) Alimentation cétogène, perte de poids et sensibilité à l’insuline :
S’il est un sujet sur toutes les lèvres depuis quelques temps, notamment sur les réseaux sociaux, c’est celui de la sensibilité à l’insuline. Beaucoup de personnes recommandent ainsi de fortement réduire/modifier sa consommation de glucides sous prétexte que cela produirait des « pics d’insuline » mauvais pour la santé. Mais gardez bien en tête que, si l’insuline existe dans le corps humain, c’est parce qu’elle y exerce un rôle physiologique fondamental. Une fois n’est pas coutume, un ou plusieurs pics d’insuline ne posent aucun problème à court ou moyen terme : il n’y a donc aucune raison de vouloir les bannir à tout prix. Le problème peut cependant survenir après plusieurs décennies de consommation glucidique inadaptée à son mode de vie. On peut dès lors en arriver à une situation de résistance à l’insuline et, ultimement, de diabète de type 2. Cette pathologie représente actuellement 4 millions de personnes en France et les chiffres ne cessent d’augmenter ces dernières années.
Et c’est la qu’intervient la diète cétogène, bien souvent présentée comme une solution efficace à la prise en charge de la résistance à l’insuline et/ou du diabète de type 2. Pour rappel, la résistance à l’insuline représente une situation ou les cellules, musculaires et hépatiques notamment, ne répondent plus bien au signal envoyé par l’insuline. En temps normal, celle-ci permet au glucose présent dans le sang de pénétrer dans les cellules par des mécanismes de translocation et de transport cellulaire (GLUT4 dans le muscle notamment). En situation de résistance à l’insuline, le glucose peine à rentrer dans les cellules et provoque une hyperinsulinémie et une hyperglycémie chronique. L’excès de glucose présent dans le compartiment sanguin est en partie converti en triglycérides et envoyé vers le tissu adipeux, et ce afin d’empêcher la glycémie de trop augmenter.
Tout d’abord, il faut savoir que la sensibilité insuline est en partie retrouvée dans le contexte d’une perte de poids (31)(32). Une perte de poids de 10% suffit en effet à améliorer sa sensibilité à l’insuline. Chez des sujets en situation d’obésité, une perte de poids de 30% suffirait à mettre en rémission le statut de résistance à l’insuline (33), notamment en réduisant la graisse abdominale et viscérale.
Nous avons déjà vu, dans la partie sur la régulation de l’appétit et des sensations de faim, que certaines études (13)(14) rapportaient une perte de poids plus importante en cétogène qu’avec une alimentation « normale ». Cette capacité de la diète cétogène à faire perdre du poids plus rapidement que les modes d’alimentation classique est également rapportée par d’autres études (34)(35)(36). Toutefois, il convient de préciser que ces bénéfices sont principalement observés de 1 à 6-9 mois. En effet, au-delà de cette durée, de nombreuses études rapportent des résultats équivalents en termes de perte de poids. C’est notamment ce que montre une étude menée par des chercheurs australiens sur près de 2 ans (37). Cela pourrait être du à la difficulté de maintenir dans le temps une diète cétogène compte tenu des enjeux sociaux et psychologiques. A long terme, il est probable que diètes cétogènes et diètes « conventionnelles » soient théoriquement équivalentes en termes de perte de poids. Cela dépendra notamment des préférences de la personne et des aspects sociaux, une fois de plus.
Toutefois, la donne semble différente pour ce qui est de la résistance à l’insuline. Preuve que la perte de poids n’est pas le seul facteur et que la répartition en macronutriments joue un rôle, notamment chez les personnes victimes de diabète de type 2. Une étude de 2014 (38) effectuée sur 33 personnes et sur une durée de 3 mois a ainsi mis en évidence une bien meilleure réduction des valeurs d’hémoglobine glyquée dans le groupe cétogène (-0.6) que dans le groupe ayant suivi l’alimentation recommandée par l’association américaine de diabétologie (-0.0). L’indice de HOMA est également passé d’une moyenne de 1.7 à 1.3 dans le groupe cétogène, alors qu’aucune évolution n’était constatée dans le groupe contrôle. Ces résultats semblent confirmés par une autre étude (39) qui montre que, même à très court terme (6 jours), une diète cétogène permet de réduire les valeurs d’insulinémie à jeun de 53% et celle du HOMA-IR de 57% ! Ces résultats semblent qui plus est confirmés par une revue systématique (40) parue en 2023 dans la revue Nutrients et qui met en évidence la supériorité du modèle cétogène en matière de prise en charge du diabète (type 1 ET type 2) et des formes de résistance à l’insuline, en comparaison avec une alimentation recommandée par les autorités de santé en la matière. La diète cétogène induit ainsi quasi systématiquement une meilleure réduction de l’Hb1Ac, de l’insuline à jeun, de la glycémie à jeun et des valeurs de HOMA-IR. Les auteurs concluent que la diète cétogène pourrait représenter une alternative ou une aide crédible aux médications utilisées classiquement dans la prise en charge du diabète de type 2. Les auteurs précisent également que la diète cétogène sera d’autant plus à même d’améliorer la sensibilité à l’insuline qu’elle sera accompagnée d’un déficit calorique. Pour autant, la suppression d’une grande majorité des glucides, la réduction de l’inflammation et la production en tant que tel de corps cétoniques (41)(42) sont autant de facteurs qui contribuent probablement à améliorer la sensibilité à l’insuline.
d) Diète cétogène et SOPK :
Tous ces facteurs pourraient aussi expliquer l’efficacité démontrée de la diète cétogène dans la prise en charge du surpoids chez des patientes atteintes du syndrome des ovaires polykystiques (SOPK) (43). En effet, plusieurs études mettent en évidence une perte de poids plus importante (44) ainsi qu’une meilleure régulation des paramètres biologiques (45) chez les patientes ayant suivi une diète cétogène en comparaison aux patientes ayant suivi une alimentation de type méditerranéenne.
e) Diète cétogène et maladies neuro-dégénératives :
Pour finir avec le sujet de la sensibilité à l’insuline, parlons également des maladies neuro-dégénératives, au premier rang desquelles on retrouve la maladie de Parkinson et la maladie d’Alzheimer. En effet, ces deux pathologies sont la résultante de plusieurs facteurs, dont notamment une résistance à l’insuline ainsi qu’une neuro-inflammation. Pas étonnant dès lors qu’une amélioration des symptômes soit souvent constatée pour ces deux pathologies après l’adoption d’une alimentation cétogène (46)(47)(48). Cependant, les études sur le sujet demeurent rares et difficiles à mener compte tenu du contexte médical assez lourd auquel sont confrontés les patients.
f) Diète cétogène, bilan lipidique et risques cardio-vasculaires :
Justement, parlons de ces fameux paramètres biologiques, source de nombreuses inquiétudes et de nombreux reproches adressés à la diète cétogène. Celle-ci est en effet souvent accusée de faire exploser les taux de cholestérol et ainsi d’être dangereuse sur le plan cardio-vasculaire. Voyons ce qu’il en est d’un peu plus près.
En ce qui concerne le fameux LDL-cholestérol d’abord, qualifié grossièrement de « mauvais cholestérol » : la plupart des données sur le sujet s’accordent à dire que la diète cétogène augmente les valeurs de LDL-cholestérol et de cholestérol total par rapport à une alimentation contrôle. Une 1ère méta-analyse Sud-coréenne, datant de 2023 et regroupant 3 essais randomisés effectués chez des personnes sans surpoids (46), nous indique une augmentation moyenne du LDL cholestérol de 1.08mmol.L et du cholestérol total de 1.47mmol/L dans le cadre d’une diète cétogène. Ces résultats sont confirmés par de nombreuses autres études (49)(50)(51) et ce quelles que soient les populations d’études concernées. Pour autant, la diète cétogène est également très souvent associée à une augmentation du HDL-cholestérol (52) et à une diminution des triglycérides sanguins (46)(53), deux tendances positives en matière de santé cardio-vasculaire.
Alors au final, que disent les études en ce qui concerne les risques d’accidents et de maladies cardio-vasculaires à long terme dans le cadre de l’alimentation cétogène ?
Une étude observationnelle (54) menée sur 44 000 Américains de 2001 à 2018 nous apprend que la diète cétogène semble plutôt associée à une diminution de la mortalité toutes causes confondues (HR = 0.76, 95% CI = 0.63-0.9, P = 0.003) sans pour autant augmenter de façon significative le risque de maladies cardio-vasculaires (HR = 1.13; CI = 0.79-1.6; P = 0.504). A ma connaissance, il n’existe malheureusement pas d’autres études permettant d’établir des corrélations entre diète cétogène et risques cardiovasculaires. Pour autant, de nombreux auteurs suggèrent que la diète cétogène aurait plutôt des effets positifs en matière de santé cardiovasculaire (55)(56)(57). Bien qu’elle semble augmenter les valeurs de cholestérol total et de LDL-cholestérol, ses effets conjoints et positifs sur les triglycérides, la sensibilité à l’insuline, les marqueurs inflammatoires ou encore la gestion du poids en font probablement un outil pertinent en matière de santé cardiovasculaire. Pour autant, l’emploi du conditionnel demeure nécessaire tant que de plus amples études n’auront pas permis d’approfondir cette question ô combien importante.
3. En pratique, ca donne quoi l’alimentation cétogène ?
C’est bien beau toutes ces études me direz-vous, mais en pratique, ça donne quoi l’alimentation cétogène ? Comment faire pour adopter une alimentation cétogène qui soit réellement bénéfique pour la santé. Voici les différents aspects qui me paraissent importants :
• Limiter au maximum votre apport en glucides : Les recommandations en la matière sont souvent situées aux alentours de 50gr/jour. Mais comme nous l’avons vu, cela peut fortement varier d’un individu à l’autre. Toujours est-il que vous devrez impérativement retirer les céréales, les légumineuses, les pâtisseries, les bonbons, les gâteaux, les farines ainsi que la plupart des fruits. Pour ces derniers, je vous recommande quand même de conserver les baies telles que les fraises, les framboises, les groseilles ou encore les myrtilles. Elles pourront contribuer à apporter de la diversité ainsi que de nombreux micro-nutriments.
• Manger assez de protéines, mais pas trop non plus : Essayez de respecter un apport quotidien en protéines situé entre 1.2 et 2gr/kg, en fonction de votre niveau d’activité physique et de votre âge. Si vous pratiquez beaucoup d’activités physiques, notamment des sports comme la musculation/le renforcement musculaire, assurez-vous de manger au minimum 1.5gr de protéines/kg/jour. Mais nul besoin d’en manger plus : vous pourriez rompre le processus de cétogenèse et ainsi freiner vos résultats.
• Conserver un apport en légumes conséquent : Dans cet article, je n’ai pas abordé la question du microbiote, principalement car le sujet est complexe et que je ne voulais pas non plus écrire un article de 15 pages. Toujours est-il que la diète cétogène est souvent associée à une réduction de la diversité microbienne, notamment à cause d’une réduction de l’apport en fibres apportées par les fruits, les légumineuses ou encore les céréales complètes. Pour pallier à cela, je vous recommande très fortement de consommer des légumes à chaque repas et de miser sur une bonne diversité : visez au moins 10 légumes différents/semaine et, si possible pour rester dans votre quota glucidique, variez au maximum les couleurs.
• Attention à la qualité des graisses consommées : Encore un point crucial et central dans l’alimentation cétogène. Puisque les lipides peuvent représenter jusqu’à 80% de l’apport calorique total, autant vous dire qu’un focus important doit être mis sur la qualité de ces graisses. Favorisez autant que possible les graisses insaturées (huile d’olive, de lin, de colza, oléagineux, avocats, œufs, poissons gras etc..). Vous pouvez bien sur consommer des acides gras saturés, notamment contenus dans les produits laitiers et les viandes grasses, mais faites attention à ce que ceux-ci ne deviennent pas majoritaires dans votre apport en graisses quotidiennes. Je vous recommande personnellement de consommer 2/3 de vos acides gras sous la forme de graisses insaturées. Veillez également à votre apport en oméga-3, dont les vertus en matière de régulation de l’inflammation et sur la santé cardio-vasculaire ne sont plus à démontrer.
• Adaptez votre dépense énergétique : Que ce soit dans votre pratique sportive et/ou dans votre vie professionnelle, il se peut que les premiers jours de diète cétogène soient difficiles si c’est votre 1ère fois. Sachez ralentir légèrement le rythme à ce moment pour permettre à votre corps de pouvoir s’adapter. N’oubliez pas également de bien vous hydrater et de consommer plus de sel que d’habitude pour compenser les pertes en sodium liées à la perte d’eau et de glycogène intervenant lors des premiers jours de cétose.
4. Conclusion
Nous avons vu au cours de cet article que la diète cétogène était un modèle alimentaire très particulier car très pauvre en glucides. Ce faisant, il est inévitablement restrictif et difficile à tenir pour la plupart des gens sur le long terme, bien que « rompre » la cétose de temps en temps ne soit en aucun cas rédhibitoire tant que cela demeure occasionnel.
En dépit de ces difficultés inévitables, le régime cétogène présente de nombreux intérêts en matière de santé métabolique : perte de poids, régulation du métabolisme de l’insuline, réduction de l’inflammation de bas grade ou encore diminution des triglycérides sanguins. Autant de points positifs qui peuvent s’avérer très importants pour les personnes en souffrance sur le plan métabolique (obésité, diabète de type 2, maladies cardio-vasculaires ou neuro-dégénératives).
Pour autant, le régime cétogène ne constitue en aucun cas un régime miracle et/ou recommandable à tous. Bien d’autres outils existent et le régime cétogène constitue seulement l’un d’entre eux. De plus, veillez à vous faire accompagner si vous décidez d’entreprendre un régime cétogène car les conséquences d’un cétogène mal fait peuvent être nombreuses.
Mais bien effectué, il peut s’avérer extrêmement efficace et bénéfique pour votre santé.
5. Références scientifiques
(1) Nguyen, T., Ta, Q., Nguyen, T., Nguyen, T., & Giau, V. (2020). Type 3 Diabetes and Its Role Implications in Alzheimer’s Disease. International Journal of Molecular Sciences, 21. https://doi.org/10.3390/ijms21093165.
(2) Michailidis, M., Moraitou, D., Tata, D., Kalinderi, K., Papamitsou, T., & Papaliagkas, V. (2022). Alzheimer’s Disease as Type 3 Diabetes: Common Pathophysiological Mechanisms between Alzheimer’s Disease and Type 2 Diabetes. International Journal of Molecular Sciences, 23. https://doi.org/10.3390/ijms23052687.
(3) Schneeweiss, B., Graninger, W., Ferenci, P., Eichinger, S., Grimm, G., Schneider, B., Laggner, A., Lenz, K., & Kleinberger, G. (1990). Energy metabolism in patients with acute and chronic liver disease. Hepatology, 11. https://doi.org/10.1002/hep.1840110309.
(4) Leaf, A., Rothschild, J., Sharpe, T., Sims, S., Macias, C., Futch, G., Roberts, M., Stout, J., Ormsbee, M., Aragon, A., Campbell, B., Arent, S., D’Agostino, D., Barrack, M., Kerksick, C., Kreider, R., Kalman, D., & Antonio, J. (2024). International society of sports nutrition position stand: ketogenic diets. Journal of the International Society of Sports Nutrition, 21. https://doi.org/10.1080/15502783.2024.2368167.
(5) Monda, A., La Torre, M., Messina, A., Di Maio, G., Monda, V., Moscatelli, F., De Stefano, M., La Marra, M., Di Padova, M., Dipace, A., Limone, P., Casillo, M., Monda, M., Messina, G., & Polito, R. (2024). Exploring the ketogenic diet’s potential in reducing neuroinflammation and modulating immune responses. Frontiers in Immunology, 15. https://doi.org/10.3389/fimmu.2024.1425816.
(6) Huang, J., Yeung, A. M., Bergenstal, R. M., Castorino, K., Cengiz, E., Dhatariya, K., Niu, I., Sherr, J. L., Umpierrez, G. E., & Klonoff, D. C. (2024). Update on Measuring Ketones. Journal of diabetes science and technology, 18(3), 714–726. https://doi.org/10.1177/19322968231152236
(7) Kraus, F., Kocijancic, M., Kluttig, A., & Ludwig-Kraus, B. (2020). Test validation, method comparison and reference range for the measurement of β-hydroxybutyrate in peripheral blood samples. Biochemia Medica, 30. https://doi.org/10.11613/bm.2020.010707.
(8) Cater, R., Chua, G., Erramilli, S., Keener, J., Choy, B., Tokarz, P., Chin, C., Quek, D., Kloss, B., Pepe, J., Parisi, G., Wong, B., Clarke, O., Marty, M., Kossiakoff, A., Khelashvili, G., Silver, D., & Mancia, F. (2021). Structural basis of omega-3 fatty acid transport across the blood–brain barrier. Nature, 595, 315 – 319. https://doi.org/10.1038/s41586-021-03650-9.
(9) Deemer, S., Plaisance, E., & Martins, C. (2020). Impact of ketosis on appetite regulation-a review.. Nutrition research, 77, 1-11 . https://doi.org/10.1016/j.nutres.2020.02.010.
(10) Stubbs, B., Cox, P., Evans, R., Cyranka, M., Clarke, K., & De Wet, H. (2017). A Ketone Ester Drink Lowers Human Ghrelin and Appetite. Obesity (Silver Spring, Md.), 26, 269 – 273. https://doi.org/10.1002/oby.22051.
(11) Okada, T., Quan, T., & Bomhof, M. (2021). Exogenous Ketones Lower Post-exercise Acyl-Ghrelin and GLP-1 but Do Not Impact Ad libitum Energy Intake. Frontiers in Nutrition, 7. https://doi.org/10.3389/fnut.2020.626480.
(12) Masi, D., Spoltore, M. E., Rossetti, R., Watanabe, M., Tozzi, R., Caputi, A., Risi, R., Balena, A., Gandini, O., Mariani, S., Spera, G., Gnessi, L., & Lubrano, C. (2022). The Influence of Ketone Bodies on Circadian Processes Regarding Appetite, Sleep and Hormone Release: A Systematic Review of the Literature. Nutrients, 14(7), 1410. https://doi.org/10.3390/nu14071410
(13) Johnstone, A., Horgan, G., Murison, S., Bremner, D., & Lobley, G. (2008). Effects of a high-protein ketogenic diet on hunger, appetite, and weight loss in obese men feeding ad libitum.. The American journal of clinical nutrition, 87 1, 44-55 . https://doi.org/10.1093/ajcn/87.1.44.
(14) Lim, S., Tay, M., Ang, S., Wai, S., Ong, K., Neo, W., Yap, Q., Chan, Y., & Khoo, C. (2024). Development and Pragmatic Randomized Controlled Trial of Healthy Ketogenic Diet Versus Energy-Restricted Diet on Weight Loss in Adults with Obesity. Nutrients, 16. https://doi.org/10.3390/nu16244380.
(15) Gibson, A. A., Seimon, R. V., Lee, C. M., Ayre, J., Franklin, J., Markovic, T. P., Caterson, I. D., & Sainsbury, A. (2015). Do ketogenic diets really suppress appetite? A systematic review and meta-analysis. Obesity reviews : an official journal of the International Association for the Study of Obesity, 16(1), 64–76. https://doi.org/10.1111/obr.12230
(16) Puchalska, P., & Crawford, P. A. (2017). Multi-dimensional Roles of Ketone Bodies in Fuel Metabolism, Signaling, and Therapeutics. Cell metabolism, 25(2), 262–284. https://doi.org/10.1016/j.cmet.2016.12.022
(17) Kimura, I., Inoue, D., Maeda, T., Hara, T., Ichimura, A., Miyauchi, S., Kobayashi, M., Hirasawa, A., & Tsujimoto, G. (2011). Short-chain fatty acids and ketones directly regulate sympathetic nervous system via G protein-coupled receptor 41 (GPR41). Proceedings of the National Academy of Sciences of the United States of America, 108(19), 8030–8035. https://doi.org/10.1073/pnas.1016088108
(18) Mårtensson, J., Björkman, L., Lind, S., Viklund, M., Zhang, L., Gutiérrez, S., Dahlgren, C., Sundqvist, M., Xie, X., & Forsman, H. (2022). The ketone body acetoacetate activates human neutrophils through FFA2R. bioRxiv. https://doi.org/10.1101/2022.12.30.522309.
(19) Li, Y., Ding, H., Wang, X., Liu, L., Huang, D., Zhang, R., Guo, L., Wang, Z., Li, X., Liu, G., Wu, J., & Li, X. (2016). High levels of acetoacetate and glucose increase expression of cytokines in bovine hepatocytes, through activation of the NF-κB signalling pathway. Journal of Dairy Research, 83, 51 – 57. https://doi.org/10.1017/s0022029915000680.
(20) Youm, Y., Nguyen, K., Grant, R., Goldberg, E., Bodogai, M., Kim, D., D’Agostino, D., Planavsky, N., Lupfer, C., Kanneganti, T., Kang, S., Horvath, T., Fahmy, T., Crawford, P., Biragyn, A., Alnemri, E., & Dixit, V. (2015). Ketone body β-hydroxybutyrate blocks the NLRP3 inflammasome-mediated inflammatory disease. Nature medicine, 21, 263 – 269. https://doi.org/10.1038/nm.3804.
(21) Neudorf, H., & Little, J. P. (2024). Impact of fasting & ketogenic interventions on the NLRP3 inflammasome: A narrative review. Biomedical journal, 47(1), 100677. https://doi.org/10.1016/j.bj.2023.100677
(22) Monda, A., La Torre, M., Messina, A., Di Maio, G., Monda, V., Moscatelli, F., De Stefano, M., La Marra, M., Di Padova, M., Dipace, A., Limone, P., Casillo, M., Monda, M., Messina, G., & Polito, R. (2024). Exploring the ketogenic diet’s potential in reducing neuroinflammation and modulating immune responses. Frontiers in Immunology, 15. https://doi.org/10.3389/fimmu.2024.1425816.
(23) Xu, W., Huang, Y., & Zhou, R. (2025). NLRP3 inflammasome in neuroinflammation and central nervous system diseases. Cellular and Molecular Immunology, 22, 341 – 355. https://doi.org/10.1038/s41423-025-01275-w.
(24) Zhang, Y., Yang, W., Li, W., & Zhao, Y. (2021). NLRP3 Inflammasome: Checkpoint Connecting Innate and Adaptive Immunity in Autoimmune Diseases. Frontiers in Immunology, 12. https://doi.org/10.3389/fimmu.2021.732933.
(25) Ren, W., Sun, Y., Zhao, L., & Shi, X. (2024). NLRP3 inflammasome and its role in autoimmune diseases: A promising therapeutic target.. Biomedicine & pharmacotherapy = Biomedecine & pharmacotherapie, 175, 116679 . https://doi.org/10.1016/j.biopha.2024.116679.
(26) Yamanashi, T., Iwata, M., Kamiya, N., Tsunetomi, K., Kajitani, N., Wada, N., Iitsuka, T., Yamauchi, T., Miura, A., Pu, S., Shirayama, Y., Watanabe, K., Duman, R., & Kaneko, K. (2017). Beta-hydroxybutyrate, an endogenic NLRP3 inflammasome inhibitor, attenuates stress-induced behavioral and inflammatory responses. Scientific Reports, 7. https://doi.org/10.1038/s41598-017-08055-1.
(27) Neudorf, H., Islam, H., Falkenhain, K., Oliveira, B., Jackson, G., Moreno-Cabañas, A., Madden, K., Singer, J., Walsh, J., & Little, J. (2024). Effect of the ketone beta-hydroxybutyrate on markers of inflammation and immune function in adults with type 2 diabetes.. Clinical and experimental immunology. https://doi.org/10.1093/cei/uxad138.
(28) Ji, J., Fotros, D., Sohouli, M. H., Velu, P., Fatahi, S., & Liu, Y. (2025). The effect of a ketogenic diet on inflammation-related markers: a systematic review and meta-analysis of randomized controlled trials. Nutrition reviews, 83(1), 40–58. https://doi.org/10.1093/nutrit/nuad175
(29) Rondanelli, M., Gasparri, C., Pirola, M., Barrile, G. C., Moroni, A., Sajoux, I., & Perna, S. (2024). Does the Ketogenic Diet Mediate Inflammation Markers in Obese and Overweight Adults? A Systematic Review and Meta-Analysis of Randomized Clinical Trials. Nutrients, 16(23), 4002. https://doi.org/10.3390/nu16234002
(30) Rosenbaum, M., Hall, K., Guo, J., Ravussin, E., Mayer, L., Reitman, M., Smith, S., Walsh, B., & Leibel, R. (2019). GLUCOSE AND LIPID HOMEOSTASIS AND INFLAMMATION IN HUMANS FOLLOWING AN ISOCALORIC KETOGENIC DIET. Obesity (Silver Spring, Md.), 27, 971 – 981. https://doi.org/10.1002/oby.22468.
(31) Clamp, L., Hume, D., Lambert, E., & Kroff, J. (2017). Enhanced insulin sensitivity in successful, long-term weight loss maintainers compared with matched controls with no weight loss history. Nutrition & Diabetes, 7. https://doi.org/10.1038/nutd.2017.31.
(32) Mora‐Rodriguez, R., Ortega, J., Ramirez-Jimenez, M., Moreno-Cabañas, A., & Morales-Palomo, F. (2020). Insulin sensitivity improvement with exercise training is mediated by body weight loss in subjects with metabolic syndrome.. Diabetes & metabolism. https://doi.org/10.1016/j.diabet.2019.05.004.
(33) Leng, M., Guo, X., Wei, C., Zhang, Y., Li, Z., Gao, X., Hou, D., & Li, C. (2025). Progressive Weight Loss-Induced Remission of Insulin Resistance/Hyperinsulinemia and Improvements in Cardiovascular Risk Factors. Diabetes, Metabolic Syndrome and Obesity, 18, 1099 – 1110. https://doi.org/10.2147/dmso.s501876.
(34) Dyńka, D., Rodzeń, Ł., Rodzeń, M., Pacholak-Klimas, A., Ede, G., Sethi, S., Łojko, D., Bartoń, K., Berry, K., Deptuła, A., Grzywacz, Ż., Martin, P., Unwin, J., & Unwin, D. (2025). Ketogenic Diets for Body Weight Loss: A Comparison with Other Diets. Nutrients, 17(6), 965. https://doi.org/10.3390/nu17060965
(35) Rafiullah, M., Musambil, M., & David, S. K. (2022). Effect of a very low-carbohydrate ketogenic diet vs recommended diets in patients with type 2 diabetes: a meta-analysis. Nutrition reviews, 80(3), 488–502. https://doi.org/10.1093/nutrit/nuab040
(36) Zhou, C., Wang, M., Liang, J., He, G., & Chen, N. (2022). Ketogenic Diet Benefits to Weight Loss, Glycemic Control, and Lipid Profiles in Overweight Patients with Type 2 Diabetes Mellitus: A Meta-Analysis of Randomized Controlled Trails. International journal of environmental research and public health, 19(16), 10429. https://doi.org/10.3390/ijerph191610429
(37) Tay, J., Thompson, C. H., Luscombe-Marsh, N. D., Wycherley, T. P., Noakes, M., Buckley, J. D., Wittert, G. A., Yancy, W. S., Jr, & Brinkworth, G. D. (2018). Effects of an energy-restricted low-carbohydrate, high unsaturated fat/low saturated fat diet versus a high-carbohydrate, low-fat diet in type 2 diabetes: A 2-year randomized clinical trial. Diabetes, obesity & metabolism, 20(4), 858–871. https://doi.org/10.1111/dom.13164
(38) Saslow, L. R., Kim, S., Daubenmier, J. J., Moskowitz, J. T., Phinney, S. D., Goldman, V., Murphy, E. J., Cox, R. M., Moran, P., & Hecht, F. M. (2014). A randomized pilot trial of a moderate carbohydrate diet compared to a very low carbohydrate diet in overweight or obese individuals with type 2 diabetes mellitus or prediabetes. PloS one, 9(4), e91027. https://doi.org/10.1371/journal.pone.0091027
(39) Luukkonen, P. K., Dufour, S., Lyu, K., Zhang, X. M., Hakkarainen, A., Lehtimäki, T. E., Cline, G. W., Petersen, K. F., Shulman, G. I., & Yki-Järvinen, H. (2020). Effect of a ketogenic diet on hepatic steatosis and hepatic mitochondrial metabolism in nonalcoholic fatty liver disease. Proceedings of the National Academy of Sciences of the United States of America, 117(13), 7347–7354. https://doi.org/10.1073/pnas.1922344117
(40) Dyńka, D., Kowalcze, K., Ambrozkiewicz, F., & Paziewska, A. (2023). Effect of the Ketogenic Diet on the Prophylaxis and Treatment of Diabetes Mellitus: A Review of the Meta-Analyses and Clinical Trials. Nutrients, 15(3), 500. https://doi.org/10.3390/nu15030500
(41) Yu, Q., Falkenhain, K., Little, J., Wong, K., Nie, J., Shi, Q., & Kong, Z. (2023). Effects of ketone supplements on blood β-hydroxybutyrate, glucose and insulin: A systematic review and three-level meta-analysis.. Complementary therapies in clinical practice, 52, 101774 . https://doi.org/10.1016/j.ctcp.2023.101774.
(42) Høgild, M., Hjelholt, A., Hansen, J., Pedersen, S., Møller, N., Wojtaszewski, J., Johannsen, M., Jessen, N., & Jørgensen, J. (2022). Ketone Body Infusion abrogates Growth Hormone Induced Lipolysis and Insulin Resistance.. The Journal of clinical endocrinology and metabolism. https://doi.org/10.1210/clinem/dgac595.
(43) Arsenaki, E., Stathi, D., Triantafyllidis, K. K., Seldon, Y., Bobotis, S., Lockett, G., Haran, S., Kyrgiou, M., Saso, S., & Kechagias, K. S. (2025). The effects of ketogenic diet on polycystic ovary syndrome: A systematic review and meta-analysis. Clinical nutrition (Edinburgh, Scotland), 56, 106535. Advance online publication. https://doi.org/10.1016/j.clnu.2025.11.019
(44) Xing, N. N., Ren, F., & Yang, H. (2024). Effects of ketogenic diet on weight loss parameters among obese or overweight patients with polycystic ovary syndrome: a systematic review and meta-analysis of randomized controlled trails. Food & nutrition research, 68, 10.29219/fnr.v68.9835. https://doi.org/10.29219/fnr.v68.9835
(45) Eshaghhosseiny, N., Ahmadi, M., Izadi, B., Vali, M., Akbari, M., Azari, I., & Akbari, H. (2024). The effects of ketogenic diet on metabolic and hormonal parameters in patients with polycystic ovary syndrome: a systematic review and meta-analysis of clinical trials. Journal of Diabetes & Metabolic Disorders, 23, 1573 – 1587. https://doi.org/10.1007/s40200-024-01441-3.
(46) Włodarek, D. (2019). Role of Ketogenic Diets in Neurodegenerative Diseases (Alzheimer’s Disease and Parkinson’s Disease). Nutrients, 11. https://doi.org/10.3390/nu11010169.
(47) Dyńka, D., Kowalcze, K., & Paziewska, A. (2022). The Role of Ketogenic Diet in the Treatment of Neurological Diseases. Nutrients, 14. https://doi.org/10.3390/nu14235003.
(48) Pietrzak, D., Kasperek, K., Rękawek, P., & Piątkowska-Chmiel, I. (2022). The Therapeutic Role of Ketogenic Diet in Neurological Disorders. Nutrients, 14. https://doi.org/10.3390/nu14091952.
(49) Joo, M., Moon, S., Lee, Y. S., & Kim, M. G. (2023). Effects of very low-carbohydrate ketogenic diets on lipid profiles in normal-weight (body mass index < 25 kg/m2) adults: a meta-analysis. Nutrition reviews, 81(11), 1393–1401. https://doi.org/10.1093/nutrit/nuad017
(50) Iatan, I., Huang, K., Vikulova, D., Ranjan, S., & Brunham, L. R. (2024). Association of a Low-Carbohydrate High-Fat Diet With Plasma Lipid Levels and Cardiovascular Risk. JACC. Advances, 3(6), 100924. https://doi.org/10.1016/j.jacadv.2024.100924
(51) Wang, Z., Chen, T., Wu, S., Dong, X., Zhang, M., & Ma, G. (2024). Impact of the ketogenic diet as a dietary approach on cardiovascular disease risk factors: a meta-analysis of randomized clinical trials. The American journal of clinical nutrition, 120(2), 294–309. https://doi.org/10.1016/j.ajcnut.2024.04.021
(52) Burén, J., Ericsson, M., Damasceno, N., & Sjödin, A. (2021). A Ketogenic Low-Carbohydrate High-Fat Diet Increases LDL Cholesterol in Healthy, Young, Normal-Weight Women: A Randomized Controlled Feeding Trial. Nutrients, 13. https://doi.org/10.3390/nu13030814.
(53) Gjuladin-Hellon, T., Davies, I., Penson, P., & Baghbadorani, R. (2018). Effects of carbohydrate-restricted diets on low-density lipoprotein cholesterol levels in overweight and obese adults: a systematic review and meta-analysis. Nutrition Reviews, 77, 161–180. https://doi.org/10.1093/nutrit/nuy049.
(54) Chawla, S., Silva, T., Medeiros, S., Mekary, R., & Radenkovic, D. (2020). The Effect of Low-Fat and Low-Carbohydrate Diets on Weight Loss and Lipid Levels: A Systematic Review and Meta-Analysis. Nutrients, 12. https://doi.org/10.3390/nu12123774.
(55) Qu, X., Huang, L., & Rong, J. (2024). The ketogenic diet has the potential to decrease all-cause mortality without a concomitant increase in cardiovascular-related mortality. Scientific reports, 14(1), 22805. https://doi.org/10.1038/s41598-024-73384-x
(56) Kosinski, C., & Jornayvaz, F. R. (2017). Effects of Ketogenic Diets on Cardiovascular Risk Factors: Evidence from Animal and Human Studies. Nutrients, 9(5), 517. https://doi.org/10.3390/nu9050517
(57) Mohammadifard, N., Haghighatdoost, F., Rahimlou, M., Rodrigues, A., Gaskarei, M., Okhovat, P., De Oliveira, C., Silveira, É., & Sarrafzadegan, N. (2022). The Effect of Ketogenic Diet on Shared Risk Factors of Cardiovascular Disease and Cancer. Nutrients, 14. https://doi.org/10.3390/nu14173499.
(58) Luo, W., Zhang, J., Xu, D., Zhou, Y., Qu, Z., Yang, Q., & Lv, Q. (2022). Low carbohydrate ketogenic diets reduce cardiovascular risk factor levels in obese or overweight patients with T2DM: A meta-analysis of randomized controlled trials. Frontiers in Nutrition, 9. https://doi.org/10.3389/fnut.2022.1092031.