1.Qu’est-ce que le SOPK ?
Le syndrome des ovaires polykystiques (SOPK) est un trouble hormonal qui touche de nombreuses femmes en âge de procréer. Les dernières données estiment qu’environ 9% des femmes dans le monde seraient concernées (1), bien que certaines études évoquent le chiffre alarmant de 20% (2) !
Quoiqu’il arrive, il semblerait que le nombre de femmes concernées ne cesse d’augmenter au cours des dernières années. Pour autant, le diagnostic reste difficile et, d’après l’OMS, 70% des femmes victimes de SOPK dans le monde ne seraient pas diagnostiquées (3). Le SOPK représente le trouble hormonal le plus fréquent chez les femmes non ménopausées et constitue l’une des premières causes de fertilité dans le monde, en plus d’entraîner des conséquences potentiellement importantes en matière de santé à long terme.
Le SOPK survient dans la plupart des cas à l’adolescence ou au début de la vie d’adulte. D’un point de vue clinique, il se caractérise par la combinaison de 3 éléments :
– Une hyperandrogénie, c’est-à-dire une élévation des taux sanguins de testostérone (totale et/ou libre) ainsi que des signes cliniques associés (pilosité, peau grasse, acné, perte de cheveux…).
– Un aspect polykystique des ovaires lors d’une échographie endovaginale : si l’un des deux ovaires comprend au moins 20 follicules antraux (2-9 mm), si le volume d’un des deux ovaires mesure au moins 10 ml, si la section d’un des ovaires comprend au moins 10 follicules. L’échographie peut être complétée par une mesure du taux d’hormone anti-mullérienne (AMH), bien que son utilisation et son interprétation soit parfois difficile, notamment chez les adolescentes (4).
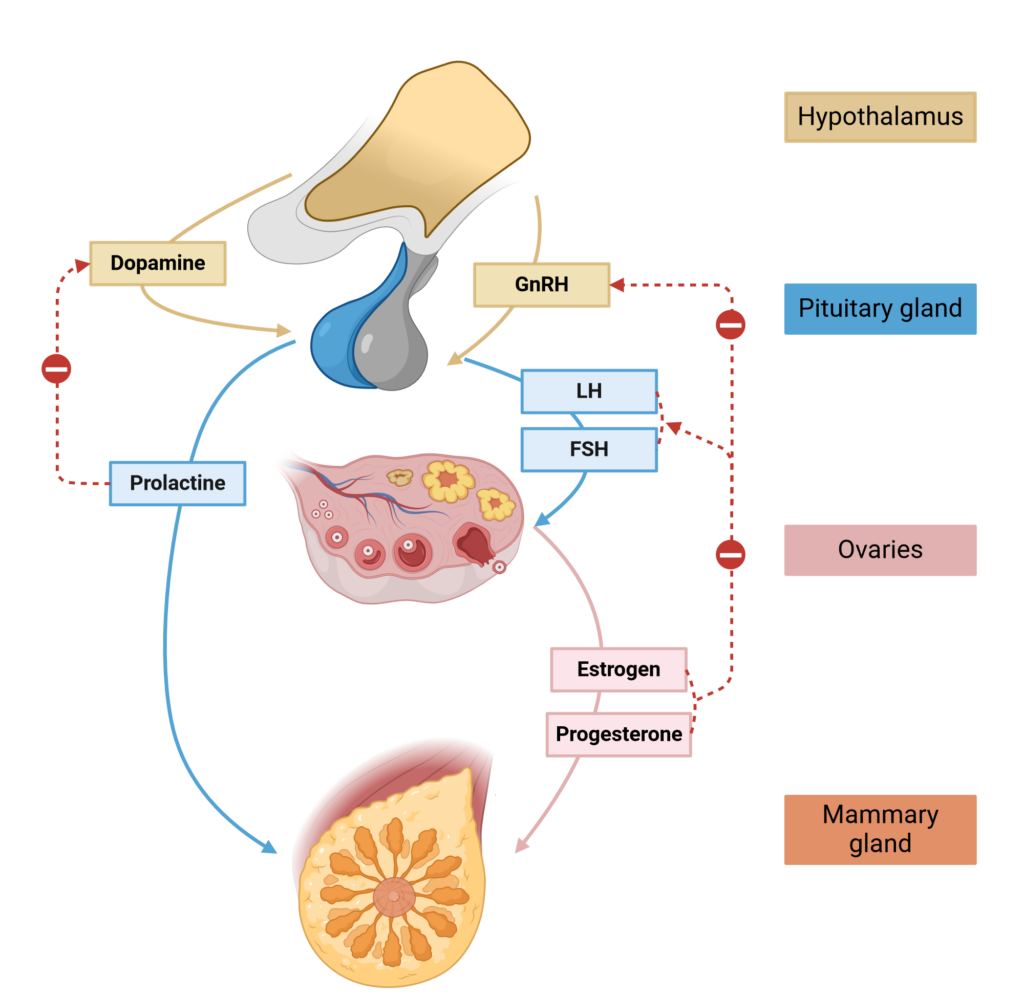
– Des troubles du cycle menstruel chroniques survenant après les 2-3 premières années de règles : Parmi ces troubles du cycle, on retrouve l’aménorrhée primaire (absence totale de règles), la présence de cycles menstruels particulièrement longs allant de plus de 35 jours (oligoménorrhée) à 6 voire 8 semaines (spanioménorrhée). Dans la plupart des cas, le SOPK s’accompagne donc de troubles de l’ovulation et donc d’une baisse de la fertilité. Ces perturbations du cycle menstruel s’expliquent par des anomalies dans le fonctionnement de l’axe hypothalamo-hypohyso-ovarien ; en effet, les femmes victimes de SOPK présentent souvent des valeurs de LH plus élevées que la moyenne, avec un ratio LH/FSH quasi-systématiquement augmenté (5) et des valeurs de FSH généralement dans la norme. Cette modification de la production de LH, contrôlée notamment par les productions pulsatiles de GnRH (cf. schéma ci-dessous) et l’AMH (6), pourrait entre autres facteurs expliquer les problématiques d’ovulation et de fertilité.
Le diagnostic de SOPK est confirmée en présence d’au moins 2 des 3 éléments mentionnés ci-dessus. En parallèle, il convient d’éliminer d’autres causes pouvant expliquer des troubles ovulatoires et/ou une hyperandrogénie. Parmi ces causes, on retrouve l’hyperprolactinémie, les troubles thyroïdiens, le syndrome de Cushing (hypercortisolisme chronique), l’hyperplasie congénitale des glandes surrénales ou encore des tumeurs ovariennes ou surrénaliennes. Exception faite des troubles thyroïdiens et de l’hyperprolactinémie, ces troubles demeurent fort heureusement assez rares.
Les causes et l’origine du SOPK demeurent à ce jour inconnues, bien que le SOPK soit clairement multifactoriel. L’origine génétique du SOPK est ainsi clairement établie (7) et, bien qu’aucun « gêne du SOPK » n’ait été clairement identifié, 19 gênes différents ont été identifiés comme potentiellement impliqués dans la survenue de la pathologie (8). Certains auteurs vont même jusqu’à suggérer que les facteurs génétiques interviendraient à hauteur de 70% dans le développement du SOPK (9), bien que ces chiffres doivent être pris avec prudence compte tenu des nombreux autres facteurs impliqués. D’autres études suggèrent qu’avoir une mère victime de SOPK multiplie par 3 le risque de le développer à son tour (10).
De nombreux autres paramètres, aussi bien environnementaux qu’épigénétiques, seraient susceptibles d’avoir un impact sur la survenue du SOPK : on retrouve parmi ces facteurs l’exposition aux perturbateurs endocriniens (11), l’obésité et les troubles métaboliques, la dysbiose intestinale (12), la consommation de tabac durant la grossesse ou encore les anomalies du profil lipidique.
Figure 1 : fonctionnement de l’axe hypothalamo-hypophyso-gonadique chez la femme
2. SOPK et conséquences en matière de santé
Bien que le SOPK ne soit pas une pathologie qui puisse mettre directement en danger la vie des femmes concernées, les conséquences du SOPK sur la santé à moyen et long terme n’en demeurent pas moins nombreuses. Voici un tour d’horizon des principaux enjeux :
Résistance à l’insuline et diabète : Le SOPK s’accompagne très souvent, voire quasi-systématiquement, de perturbations au niveau de la production de testostérone et de la sensibilité à l’insuline. Les deux phénomènes sont concomitants et créent un véritable cercle vicieux ou la présence de l’un renforce l’autre, et réciproquement (13). Des taux élevés d’insuline dans le sang sont notamment suspectés d’augmenter la production de testostérone au niveau des cellules ovariennes de la thèque interne (14) et de réduire le taux de protéines de transport de la testostérone (SHBG), augmentant ainsi la fraction libre et biodisponible (15).
Toujours est-il que le SOPK augmente significativement les risques de développer un diabète de type 2 (DT2) à terme. Cela est particulièrement vrai chez les femmes en situation d’obésité (16)(17) ou le risque semble multiplié par 2 à 4 en comparaison de femmes en situation d’obésité mais non victimes de SOPK. Une étude espagnole rapporte même une multiplication par 18 des risques de DT2 chez des adolescentes victimes de SOPK et d’obésité (18). Considérant que plus de 50% des femmes victimes de SOPK seraient également en situation d’obésité (19), les enjeux en matière de santé métabolique sont énormes. Heureusement, ces risques accrus en matière de DT2 ne semblent pas retrouvés chez les femmes victimes de SOPK mais ayant un indice de masse corporel (IMC) inférieur à 25 (20).
Impacts sur la sphère cardio-vasculaire : Toujours d’un point de vue métabolique, le SOPK est associé à des risques accrus sur le plan cardio-vasculaire et inflammatoire. Une méta-analyse de 20202 (21) et regroupant 23 études nous indique que le SOPK est associé à une augmentation de 75% (RR : 1.75, 95% CI 1.42 to 2.15) du risque de développer de l’hypertension et un risque accru de 41% (RR: 1.41, 95% CI 1.02 to 1.94) de subir un accident cardio-vasculaire non fatal. Cette étude mentionne également une réduction fréquente des valeurs de HDL-cholestérol, reconnu comme étant cardioprotecteur jusqu’à un certain point (22), ainsi qu’une augmentation des valeurs de triglycérides sanguins. Ces chiffres sont très semblables à ceux que l’on retrouve dans une autre méta-analyse (23), regroupant cette fois quasiment 1 millions de femmes, dont 400 000 victimes de SOPK. Le risque d’être victime d’une pathologie cardio-vasculaire était augmenté de 68% (OR, 1.68 [95% CI, 1.26-2.23]; I= 71.0%) chez les femmes victimes de SOPK. Pour autant, il n’est pas clairement établi dans cette étude que le SOPK augmente la mortalité par causes cardio-vasculaires (OR, 1.19 [95% CI, 0.53-2.69]; I= 0%).
Cette augmentation du risque cardio-vasculaire pourrait notamment être liée à un état d’inflammation souvent retrouvé chez les femmes victimes de SOPK. C’est en tout cas ce que démontre une méta-analyse effectuée à ce sujet (24) et regroupant 7000 femmes réparties sur 63 études. Le stress oxydatif semble également jouer un rôle majeur dans la survenue et le développement du SOPK, et pourrait également expliquer l’augmentation du risques de maladies cardio-vasculaire. Une méta-analyse de 2013 (25) regroupant la aussi 7000 femmes a mis en évidence des niveaux accrus de molécules pro-oxydantes ainsi que des défenses antioxydantes réduites chez les femmes victimes de SOPK.
Effets sur la fertilité et la grossesse : Comme évoqué dans la 1ère partie, le SOPK est très souvent associé à des perturbations de la fonction ovulatoire. La qualité de l’endomètre est également souvent diminuée par manque de progestérone (26) et à cause de l’inflammation de bas grade. Par conséquent, les troubles de la fertilité s’avèrent très fréquents chez les femmes concernées. D’après les dernières données sur le sujet, c’est près de 70% des femmes victimes de SOPK qui éprouveraient des difficultés à concevoir, contre 10 à 20% dans la population générale. Une fois enceinte, le risque de fausses couches serait quant à lui augmenté d’environ 50% (27)(28). Même chose pour ce qui est du risque de diabète gestationnel pour la maman, qui pourrait être multiplié par 2 ou par 3. Enfin, le risque de donner naissance à un enfant prématuré est également accru en cas de SOPK. Fort heureusement (enfin une bonne nouvelle, me direz-vous ☹), le SOPK ne semble en aucun cas augmenter la mortalité infantile, notamment au moment de l’accouchement.
SOPK et santé mentale : Au vu des nombreuses conséquences du SOPK en matière de santé métabolique, de prise de poids ou encore de fertilité, il n’est pas étonnant de constater que le SOPK est associé à une augmentation des risques de troubles dépressifs et anxieux. Une méta-analyse de 2020 (29) effectuée sur près de 30 000 femmes démontre en effet une augmentation des épisodes de dépression ainsi qu’une anxiété accrue au quotidien. Ces résultats sont confirmés par de nombreux autres travaux (30)(31). L’insatisfaction corporelle semble elle aussi augmentée en cas de SOPK, probablement en lien avec les problématiques métaboliques et l’hyperandrogénie (32).
SOPK et écosystème intestinal : Une partie des conséquences sur la santé évoquées ci-dessus pourrait également avoir un lien avec l’écosystème intestinal. En effet, de plus en plus d’études récentes suggèrent l’importance du microbiote intestinal dans la régulation de processus comme la sensibilité à l’insuline, les maladies cardio-vasculaires ou encore l’inflammation de bas grade. Avant toute chose, rappelons que le sujet du microbiote est encore relativement nouveau et doit être considéré avec précautions ; ceci étant dit, plusieurs études rapportent une diminution de l’alpha diversité (nombre d’espèces bactériennes présentes au sein du microbiote d’un même individu) au niveau du microbiote intestinal chez les femmes victimes de SOPK, par rapport à des femmes « contrôles » (33)(34). Pour autant, cette réduction de la diversité microbienne n’est pas systématiquement retrouvée (35) et certains auteurs parlent plutôt d’une « altération » du microbiote : sans être forcément meilleur ou moins bon, le microbiote des femmes victimes de SOPK serait surtout différent. Il serait ainsi moins riche en bactéries productrices d’acides gras à chaîne courte (butyrate notamment) de type Akkermensia, Lactobacilles ou Bifidobactéries (36) et plus riche en bactéries à Gram négatif de type Bactéroïdes ou Escherichia / Shigella (37), avec des différences observées en fonction de la présence ou non de résistance à l’insuline et d’obésité. Le microbiote intestinal des femmes victimes de SOPK serait ainsi orienté en faveur du développement d’un statut d’inflammation de bas grade (38).
Cette « signature microbienne » pourrait également engendrer une augmentation de la production d’endotoxines comme les lipopolysaccharides (LPS), produits par la membrane externe des bactéries à Gram négatives mentionnées plus haut. Cet état d’endotoxémie est retrouvé dans plusieurs études récentes (39)(40) et pourrait, entre autres facteurs, expliquant la présence d’un état d’inflammation de bas grade, bien souvent caractérisé par une protéine C réactive (CRP) élevée chez les femmes victimes de SOPK.
Cette endotoxémie serait également associée à une augmentation de la perméabilité intestinale puisqu’une augmentation des LPS et des protéines de transport de ces LPS (LBP ; lipopolysaccharides binding protein) a été constatée chez de nombreuses femmes victimes de SOPK (41), qu’elle soient ou non en situation d’obésité.
Reste à savoir si cette « signature bactérienne » et ces particularités métabolomiques retrouvées chez les femmes victimes de SOPK font plutôt office de causes et/ou de conséquences du SOPK !
3. SOPK et alimentation
Il n’en demeure pas moins qu’en terme d’alimentation, les enjeux relatifs au SOPK sont nombreux : réduction de l’inflammation, régulation de la dysbiose intestinale, prise en charge de la résistance à l’insuline et des perturbations métaboliques associées, atteinte ou maintien d’un poids « normal » permettant d’éviter la survenue de complications comme le diabète de type 2 ou encore optimisation du fonctionnement cérébral et psychique afin de limiter de potentielles dépressions ou autres troubles anxieux.
SOPK et teneur en glucides : En ce qui concerne les paramètres métaboliques, plusieurs méta-analyses mettent en avant la pertinence des diètes low-carb (faible en glucides) et cétogènes (très faible en glucides) pour engendrer une perte de poids (42)(43), améliorer la sensibilité à l’insuline ainsi que les paramètres du profil lipidique tels que les triglycérides ou le cholestérol.
Mais plutôt que de savoir si les diètes faibles en glucides sont efficaces pour la prise en charge du SOPK, posons-nous la question de savoir si elles sont plus efficaces que des modèles comme l’alimentation méditerranéenne.
Et ça tombe bien, car plusieurs études ont été faites sur le sujet. Tout d’abord, on retrouve un essai randomisé (44) de 2024 ayant été conduit sur 40 femmes. 21 constituaient un premier groupe et étaient assignées à une alimentation modérée en glucides (40% des calories) et dépourvue de produits animaux. Cette diète contenait également 5 aliments considérés comme faisant baisser le cholestérol, à savoir les noix, les phytostérols, les acides gras monoinsaturés, les fibres solubles et les protéines végétales comme le soja. D’un autre côté, on retrouvait 19 femmes suivant une alimentation de type cétogène, c’est-à-dire très riche en graisses (70% des calories quotidiennes). Au bout de 8 semaines d’expérimentation, il s’est avéré que les paramètres métaboliques et hormonaux étaient améliorés de façon plus importante dans le groupe cétogène. Les participantes avaient en effet perdu plus de poids et observé une réduction plus importante des valeurs de LH. Cependant, les paramètres lipidiques, en l’occurrence les triglycérides et le LDL-cholestérol se sont avérés meilleurs dans le groupe ayant adopté une alimentation végétale.
Ces résultats semblent confirmés par une autre étude italienne datant de 2023 (45) et ayant comparé les effets à court terme d’une alimentation de type cétogène à ceux d’une alimentation hypocalorique de type méditerranéenne ; bien que le détail de l’étude ne soit malheureusement pas disponible sur internet, les auteurs rapportent une perte de poids plus importante au sein du groupe cétogène que chez les participantes ayant respecté une alimentation méditerranéenne. Les paramètres hormonaux et métaboliques semblent également avoir été améliorés de façon plus importante au sein du groupe cétogène.
Enfin, mentionnons une étude de 2023 (46) conduite pendant 9 semaines auprès de 80 femmes, réparties aléatoirement dans 2 groupes : un 1er groupe ayant pour consigne d’adopter une alimentation cétogène, et un second une diète méditerranéenne. Le groupe cétogène mangeait 1.2gr de protéines/kg chaque jour, avec un apport en glucides de maximum 30g et un apport en lipides de 30gr également… vous l’aurez compris, les apports caloriques au sein de ce groupe étaient limités à hauteur de 600kcal. Concernant l’autre groupe, les apports caloriques étaient déterminés de façon individuelle via un nutritionniste au début du protocole, sans que l’on aient plus d’informations à ce sujet. Il y a fort à parier cependant qu’ils aient été supérieurs à ceux de l’autre groupe. Pas étonnant donc que les femmes ayant suivi une alimentation cétogène aient perdu en moyenne plus de poids (-10.9kg) que celles du groupe méditerranéen (-5.1kg). Les résultats étaient également meilleurs au sein du groupe cétogène en ce qui concerne les triglycérides, le LDL-cholestérol, la LH et la FSH.
Malheureusement, cette étude ne semble que très peu applicable à la pratique compte tenu de l’apport calorique journalier extrêmement faible. Une étude de 2022 (47) nous indique toutefois qu’un modèle méditerranéen de type low-carb pourrait également s’avérer efficace au quotidien ; dans cette étude, 36 femmes suivaient un modèle faible en lipides, avec un maximum de 40gr de graisses au quotidien et moins de 10% de l’apport énergétique sous forme de graisses saturées. Dans le groupe low-carb, les glucides étaient limités à hauteur de 100gr/jour et les apports en protéines et en graisses augmentés, en plus de devoir respecter les bases de l’alimentation méditerranéenne (huile d’olive, céréales complètes, légumes, apports modérés en protéines animales). A l’issue des 12 semaines, la perte de poids s’est avéré plus importante dans le groupe low-carb (-6.10 ± 1.52 kg vs -4.79 ± 0.97 kg, P < 0.05) que dans le groupe low-fat. La même chose était observée pour le % de masse grasse (-2.97% ± 1.78% vs -1.19% ± 0.91%, P < 0.05) ainsi que pour les valeurs de LH (-5.28 ± 3.31 mIU/mL vs -3.39 ± 3.64 mIU/mL, P < 0.05) et le ratio LH/FSH (-1.18 ± 0.75 vs -0.66 ± 1.05, P < 0.05).
A la vue de ces différentes études et en attendant des études à plus long terme, il semblerait que les modèles alimentaires faibles en glucides représentent de bons outils pour la prise en charge alimentaire du SOPK. Toutefois, ces outils devront être adaptés en fonction notamment des paramètres psychologiques et sociaux relatifs à chaque femme. L’adhérence à long terme à un type d’alimentation étant l’un des paramètres les plus importants pour pouvoir observer des effets bénéfiques sur la santé.
SOPK et consommation de végétaux : Les femmes victimes de SOPK auraient tendance à consommer moins de légumes et de végétaux (48) que des femmes n’ayant pas de SOPK. Cette conclusion pourrait expliquer les altérations du microbiote intestinal observées chez les femmes atteintes de la maladie. Ce faisant, l’un des enjeux majeurs de l’alimentation dans le cadre du SOPK est de retrouver une teneur importante en fruits, légumes et légumineuses. La richesse en polyphénols de ces aliments serait associée à une évolution favorable de la maladie et à une diminution des symptômes (49)(50). Bien qu’aucun essai randomisé n’ait directement étudié le lien entre la consommation de végétaux et l’évolution du microbiote intestinal chez des femmes souffrant de SOPK, il est aujourd’hui clairement établi qu’un régime végétarien ou végan est associé à un microbiote intestinal de meilleure qualité (51). Or il est probable que la résistance à l’insuline observée chez la plupart des femmes souffrant de SOPK soit en partie due à une dysbiose intestinale, à une hyperperméabilité intestinale et à une endotoxémie (52). L’un des enjeux relatif à l’amélioration du microbiote serait ainsi d’augmenter la production d’interleukine-22 (IL-22) et d’acide biliaire (53)(54). En effet, chez les femmes victimes de SOPK, les taux d’IL-22 et d’acides biliaires semblent plus bas que chez des femmes « saines ». Cela pourrait notamment être causé par la prédominance d’une bactérie bien spécifique, nommée Bacteroides Vulgatus et qui, lorsqu’elle est transférée à des souris saines, contribue au développement d’une résistance à l’insuline ains qu’à une dysfonction ovarienne.
Bref, vous l’aurez compris, une alimentation riche en végétaux et en fibres semble capitale dans la prise en charge à moyen et long terme du SOPK. En agissant favorablement sur le microbiote intestinal, ce type d’alimentation pourrait permettre d’améliorer la sensibilité à l’insuline et l’inflammation de bas grade tout en augmentant l’activité de certaines voies métaboliques (IL-22) qui semblent diminuées chez les femmes atteintes de SOPK.
SOPK et apports en oméga-3 : En plus de la question des glucides et des végétaux, celle des oméga-3 s’avère également très importante en cas de SOPK. En effet, nous avons expliqué précédemment que le SOPK se caractérisait notamment par un état d’inflammation de bas grade. Or le rôle des oméga-3 à longues chaînes (EPA – DHA) dans la régulation de l’inflammation de bas grade n’est plus à démontrer (55). On ne sera donc pas surpris d’apprendre que, chez des femmes victimes de SOPK, la quantité d’EPA et de DHA dans l’alimentation et dans le sang est inversement corrélée à la résistance à l’insuline mesurée par l’indice HOMA (56). A noter que dans cette étude, les apports en oméga-3 à longues chaînes étaient assurés en très grande majorité via l’alimentation. On recommandera donc la consommation de 3 à 5 portions/semaine de petits poissons gras comme les sardines ou les maquereaux. Le saumon et la truite pourront bien entendu être consommés compte tenu de leurs teneurs élevées en oméga-3, mais ceux-ci sont également plus riches en toxines et en métaux lourds. Pour les femmes ne souhaitant pas manger de poissons, la supplémentation en oméga-3 sera donc un enjeu important. Nous y reviendrons dans la partie sur les compléments.
Autres enjeux en matière d’alimentation : Bien entendu, il conviendra dans le cas du SOPK de garantir un apport en protéines suffisant et adapté au profil de chacune. Pour des personnes sédentaires, on recommandera au minimum 1 à 1.2gr de protéines/kg de poids corporel et par jour. Pour les femmes sportives, cet apport pourra être augmenté à 1.5 voir 2gr, sauf en cas de dysfonction rénale. Les protéines permettront de garantir un bon rassasiement et ainsi une bonne régulation de l’apport calorique journalier.
On veillera également à limiter les acides gras saturés et trans, associés à de potentiels déséquilibres en ce qui concerne le microbiote intestinal, le stress oxydatif et la résistance à l’insuline (57). A l’inverse, on privilégiera les acides gras mono et polyinsaturés contenus par exemple dans l’huile d’olive, les avocats, les oléagineux et les poissons gras.
4. Les compléments utiles en cas de SOPK
Après avoir abordé les enjeux relatifs à l’alimentation, intéressons nous désormais à l’impact de certains compléments alimentaires sur les symptômes au quotidien du SOPK.
Oméga-3 : Puisque nous en parlions il y a peu, entamons avec la question des oméga-3 en gélules. De nombreuses méta-analyses issues d’essais randomisés contrôlés suggèrent que la supplémentation en oméga-3 pourrait diminuer la résistance à l’insuline, la LH, les triglycérides ou encore la CRP (58)(59)(60). La supplémentation en oméga-3 permettrait ainsi de réduire les complications couramment associées comme le DT2 ou les maladies cardio-vasculaires (61). Attention cependant à bien choisir ses oméga-3 : privilégiez des gélules ayant la mention « EPAX » et garantissant un faible niveau de peroxydation (indice TOTOX <10). Stockez les au frigo et favorisez autant que possible les conditionnements de 30 jours afin que les oméga-3 n’aient pas le temps de s’oxyder. Dans les études, les bénéfices observés sont situés pour des doses allant de 1 à 3gr/jour. En ce qui concerne le ratio EPA :DHA, il semblerait qu’un ratio allant de 1 :1 à 3 :1 en faveur du DHA soit plus efficace pour la réduction de l’inflammation de bas grade (62)(63). En ce qui concerne la prise en charge des troubles de l’humeur et des épisodes de dépression, il semblerait à l’inverse que l’EPA soit à privilégier (64).
Vitamine D : Au même titre que les oméga-3, la vitamine D apparaît comme un complément fondamental dans la gestion et la prise en charge du SOPK, notamment pour sa capacité à réguler les processus inflammatoires. Cela semble d’autant plus vrai chez les femmes en situation de déficit/de carence mais rappelons que la carence en vitamine D est présente chez 80 à 90% des Français au cours de l’hiver. La supplémentation en vitamine D permettrait ainsi d’améliorer la fonction reproductive et ovulatoire chez les femmes victimes de SOPK (65)(66). Elle favoriserait également la diminution de la résistance à l’insuline (67) et l’amélioration du profil lipidique (68).
Probiotiques : En plus de la vitamine D et des oméga-3, il semblerait que la supplémentation en probiotiques puisse avoir un effet positif sur les symptômes et les conséquences du PCOS ! Une méta-analyse de 2023 (69) a en effet démontré, sur près de 1000 participants et 17 essais randomisés, que la supplémentation en probiotiques, en prébiotiques ou en symbiotiques (prébiotiques + probiotiques), permettait de réduire la résistance à l’insuline (SMD, -0.73; 95% CI, -1.15 to -0.31; p = 0.001), le taux de triglycérides sanguins (SMD, -0.85; 95% CI, -1.59 to -0.11; p = 0.024) et les valeurs de cholestérol totaux et LDL (SMD, -0.84; 95% CI, -1.64 to -0.03; p = 0.041). Il semblerait également qu’une supplémentation en probiotiques soit en mesure de réguler les taux de LH, le ratio LH/FSH ainsi que d’augmenter les valeurs de SHBG (70)(71). La même chose a été observée sur une supplémentation en symbiotiques de 6 mois (72). Enfin, concernant la perméabilité intestinale, les probiotiques semblent aussi avoir un impact positif sur les valeurs de LBP mesurées, avec une réduction constatée de l’ordre de 21% (72) au sein d’une étude randomisée de 6 mois. De manière intéressante, une étude (73) a mis en évidence que la supplémentation en probiotiques.
Co-enzyme Q10 : De nombreuses études montrent qu’une supplémentation en co-enzyme Q10 pourrait également être efficace pour réduire les symptômes et les conséquences négatives du SOPK. Une méta-analyse regroupant 9 RCT et 1000 patients (74) a ainsi mis en évidence qu’une supplémentation de 100 à 200mg/jour pouvait faire baisser la résistance à l’insuline (WMD - 0.67 [- 0.87, - 0.48], P < 0.00001), les taux de testostérone (SMD - 0.28 [- 0.49, - 0.06], P = 0.01), de cholestérol totaux (SMD - 0.35 [- 0.56, - 0.14], P = 0.001) et de LDL-cholestérol (SMD - 0.22 [- 0.43, - 0.01], P = 0.04). En tant que molécule antioxydante et régulatrice du stress oxydatif, le co-enzyme Q10 permettrait également de faire baisser les niveaux d’inflammation (75)(76) tout en augmentant les capacités antioxydantes de l’organisme.
Zinc : La supplémentation en zinc à hauteur de 50mg/jour pourrait également contribuer à faire baisser la résistance à l’insuline (77) chez des femmes victimes de SOPK. Ceci est probablement d’autant plus vrai chez des personnes déficientes en zinc, considérant que le déficit en zinc est finalement plus fréquent que ce que l’on pense et devrait être monitoré au niveau biologique.
Myo-inositol : L’un des compléments les plus prometteurs en ce qui concerne la prise en charge du SOPK. Anciennement considéré comme la vitamine B7, cette appellation a depuis été revue compte tenu de la capacité du corps à produire lui-même l’inositol à partir du glucose. Le myo-inositol fait partie des 9 isomères de l’inositol que l’on retrouve dans le corps mais correspond à la forme la plus fréquemment rencontrée. Il joue un rôle majeur en tant que molécule de signalisation cellulaire et en tant que composant de la membrane des cellules.
Dans le cas du SOPK, la supplémentation en myo-inositol à hauteur de 2-4gr/jour permettrait notamment de réduire la résistance à l’insuline (78) et les valeurs de HOMA associées (SMD = -0.585, 95% CI: -1.145 to -0.025, = 0.041). La supplémentation en myo-inositol permettrait également de réduire les valeurs LH (79) et d’augmenter celles de SHBG (80). Enfin, et c’est peut-être le plus important, la prise de myo-inositol pourrait permettre de restaurer un cycle menstruel normal à l’issue de 3 mois de supplémentation. C’est ce que suggère une première étude (81) ou la prise de 2gr/jour de myo-inositol pendant 12 semaines chez 50 femmes victimes de SOPK a permis à l’ensemble des participantes de retrouver un cycle menstruel normal. Dans une autre étude (78), la prise de 2x1gr/jour de myo-inositol pendant 6 mois a permis à 68% des 90 femmes inclues dans l’étude de retrouver un cycle menstruel normal. Enfin, une méta-analyse (82) effectuée sur la question et regroupant quasiment 1500 femmes victimes de SOPK a découvert que la supplémentation en myo-inositol permettait à 20% des femmes de retrouver des cycles menstruels normaux. Au sein de cette même étude, le myo-inositol ne permettait cependant d’augmenter les taux de grossesse, en comparaison aux groupes contrôles ou à la prise de metformine.
Il existe donc de nombreux compléments alimentaires susceptibles d’avoir un impact sur la fonction reproductive et la santé des femmes victimes de SOPK. Les stratégies en termes de compléments alimentaires devront bien entendu rester individuelles et basées aussi bien sur des tests biologiques que sur les symptômes cliniques expérimentés par les patientes.
5. SOPK et hygiène de vie
En plus des compléments alimentaires, plusieurs aspects liés à l’hygiène de vie des patientes victimes de SOPK doivent également être mentionnés.
Premièrement, tous les aspects susceptibles d’accentuer les déséquilibres hormonaux et les risques de dysbiose intestinale doivent être appréhendés et, si possible, limités. Parmi ceux-ci, on retrouve notamment la consommation d’alcool et de cigarette ainsi que l’exposition à des niveaux élevés de stress.
Une attention toute particulière devrait également être apportée au sommeil, aussi bien sur la qualité que sur la quantité. L’obésité souvent associée au SOPK peut en effet augmenter les risques d’apnées obstructives du sommeil (83). Qui plus est, la dette chronique de sommeil modifie les comportements alimentaires et la production hormonale en charge de réguler l’appétit et la satiété. Cette même dette de sommeil peut également aggraver la dysbiose intestinale (84) et la résistance à l’insuline (85), déjà problématiques dans l’étiologie de la maladie.
Enfin, comment ne pas parler du rôle de l’activité physique dans la prise en charge et l’accompagnement des femmes victimes de SOPK. La résistance à l’insuline étant l’un des enjeux majeurs de la pathologie sur le plan physiologique, la pratique d’une activité physique régulière sera donc d’autant plus importante pour les femmes concernées. En effet, la pratique d’une activité physique régulière, notamment en endurance (vélo, course, marche, randonnée, natation), a des effets clairement reconnus sur la réduction de la résistance à l’insuline (86)(87). Il semblerait de plus que la pratique d’une activité en endurance soit plus efficace que la pratique du renforcement musculaire (88)(89). Cette dernière peut apporter de nombreux autres bénéfices mais, dans le cadre du SOPK et la résistance à l’insuline, il paraît nécessaire de faire de l’endurance le socle de sa pratique !
6. Conclusion
Le SOPK est une pathologie hormonale et inflammatoire complexe, multifactorielle et malheureusement de plus en plus fréquente chez les femmes en âge d’avoir des enfants. Il se caractérise par une hyperandrogénie clinique et/ou biologique, des ovaires ayant une morphologie particulière à l’imagerie ainsi que par des règles irrégulières ou absentes.
L’enjeu de cette pathologie sera notamment d’éviter les complications telles que l’obésité, le diabète de type 2 ou encore les troubles dépressifs. On cherchera ainsi à garder une bonne sensibilité à l’insuline, limiter l’inflammation de bas grade et améliorer le fonctionnement hormonal, tant au niveau de la testostérone que de la LH.
Pour cela, on misera sur une alimentation riche en fibres, en antioxydants, en oméga-3 et avoir un apport modéré à faible en glucides. La prise de certains compléments pourra également aider au niveau de la résistance à l’insuline et de la fonction ovulatoire.
Enfin, il va sans dire qu’on cherchera à limiter autant que possible la consommation d’aliments ultra-transformés, d’alcool et de tabac, tout en adoptant une activité physique régulière plutôt basée sur l’entrainement en endurance.
7. Références scientifiques
(1) Salari, N., Nankali, A., Ghanbari, A., Jafarpour, S., Ghasemi, H., Dokaneheifard, S., & Mohammadi, M. (2024). Global prevalence of polycystic ovary syndrome in women worldwide: a comprehensive systematic review and meta-analysis. Archives of Gynecology and Obstetrics, 310, 1303 – 1314. https://doi.org/10.1007/s00404-024-07607-x.
(2) Deswal, R., Narwal, V., Dang, A., & Pundir, C. (2020). The Prevalence of Polycystic Ovary Syndrome: A Brief Systematic Review. Journal of Human Reproductive Sciences, 13, 261 – 271. https://doi.org/10.4103/jhrs.jhrs_95_18.
(3) https://www.who.int/fr/news-room/fact-sheets/detail/polycystic-ovary-syndrome
(4) Van Der Ham, K., Laven, J., Tay, C., Mousa, A., Teede, H., & Louwers, Y. (2024). Anti-Müllerian hormone as a diagnostic biomarker for Polycystic Ovary Syndrome (PCOS) and Polycystic Ovarian Morphology (PCOM): a systematic review and meta-analysis.. Fertility and sterility. https://doi.org/10.1016/j.fertnstert.2024.05.163.
(5) Malini, N., & George, R. (2017). Evaluation of different ranges of LH:FSH ratios in polycystic ovarian syndrome (PCOS) – Clinical based case control study.. General and comparative endocrinology, 260, 51-57 . https://doi.org/10.1016/j.ygcen.2017.12.007.
(6) Pratama, G., Wiweko, B., Asmarinah, Widyahening, I. S., Andraini, T., Bayuaji, H., & Hestiantoro, A. (2024). Mechanism of elevated LH/FSH ratio in lean PCOS revisited: a path analysis. Scientific reports, 14(1), 8229. https://doi.org/10.1038/s41598-024-58064-0
(7) Khan, M., Ullah, A., & Basit, S. (2019). Genetic Basis of Polycystic Ovary Syndrome (PCOS): Current Perspectives. The Application of Clinical Genetics, 12, 249 – 260. https://doi.org/10.2147/tacg.s200341.
(8) Hiam, D., Moreno-Asso, A., Teede, H., Laven, J., Stepto, N., Moran, L., & Gibson-Helm, M. (2019). The Genetics of Polycystic Ovary Syndrome: An Overview of Candidate Gene Systematic Reviews and Genome-Wide Association Studies. Journal of Clinical Medicine, 8. https://doi.org/10.3390/jcm8101606.
(9) Mykhalchenko, K., Lizneva, D., Trofimova, T., Walker, W., Suturina, L., Diamond, M., & Azziz, R. (2017). Genetics of polycystic ovary syndrome. Expert Review of Molecular Diagnostics, 17, 723 – 733. https://doi.org/10.1080/14737159.2017.1340833.
(10) Boldis, B., Grünberger, I., Cederström, A., Björk, J., Nilsson, A., & Helgertz, J. (2023). Early Life Factors and Polycystic Ovary Syndrome in a Swedish Birth Cohort. International Journal of Environmental Research and Public Health, 20. https://doi.org/10.3390/ijerph20227083.
(11) Merkin, S., Phy, J., Sites, C., & Yang, D. (2016). Environmental determinants of polycystic ovary syndrome.. Fertility and sterility, 106 1, 16-24 . https://doi.org/10.1016/j.fertnstert.2016.05.011.
(12) Singh, S., Pal, N., Shubham, S., Sarma, D., Verma, V., Marotta, F., & Kumar, M. (2023). Polycystic Ovary Syndrome: Etiology, Current Management, and Future Therapeutics. Journal of Clinical Medicine, 12. https://doi.org/10.3390/jcm12041454.
(13) Zeng, X., Xie, Y., Liu, Y., Long, S., & Mo, Z. (2019). Polycystic Ovarian Syndrome: Correlation Between Hyperandrogenism, Insulin Resistance and Obesity.. Clinica chimica acta; international journal of clinical chemistry. https://doi.org/10.1016/j.cca.2019.11.003.
(14) Houston, E., & Templeman, N. (2025). Reappraising the relationship between hyperinsulinemia and insulin resistance in PCOS. The Journal of Endocrinology, 265. https://doi.org/10.1530/joe-24-0269.
(15) Xing, C., Zhang, J., Zhao, H., & He, B. (2022). Effect of Sex Hormone-Binding Globulin on Polycystic Ovary Syndrome: Mechanisms, Manifestations, Genetics, and Treatment. International Journal of Women’s Health, 14, 91 – 105. https://doi.org/10.2147/ijwh.s344542.
(16) Anagnostis, P., Paparodis, R., Bosdou, J., Bothou, C., Macut, D., Goulis, D., & Livadas, S. (2021). Risk of type 2 diabetes mellitus in polycystic ovary syndrome is associated with obesity: a meta-analysis of observational studies. Endocrine, 74, 245 – 253. https://doi.org/10.1007/s12020-021-02801-2.
(17) Rubin, K., Glintborg, D., Nybo, M., Abrahamsen, B., & Andersen, M. (2017). Development and Risk Factors of Type 2 Diabetes in a Nationwide Population of Women With Polycystic Ovary Syndrome. The Journal of Clinical Endocrinology & Metabolism, 102, 3848–3857. https://doi.org/10.1210/jc.2017-01354.
(18) Hudnut-Beumler, J., Kaar, J., Taylor, A., Kelsey, M., Nadeau, K., Zeitler, P., Snell-Bergeon, J., Pyle, L., & Cree‐Green, M. (2021). Development of type 2 diabetes in adolescent girls with polycystic ovary syndrome and obesity. Pediatric Diabetes, 22, 699 – 706. https://doi.org/10.1111/pedi.13206.
(19) Anagnostis, P., Paparodis, R., Bosdou, J., Bothou, C., Goulis, D., Macut, D., Dunaif, A., & Livadas, S. (2021). The Major Impact of Obesity on the Development of Type 2 Diabetes (T2D) in Women With PCOS: A Systematic Review and Meta-Analysis of Observational Studies. Journal of the Endocrine Society, 5, A746 – A747. https://doi.org/10.1210/jendso/bvab048.1517.
(20) Ollila, M., West, S., Keinänen-Kiukaanniemi, S., Keinänen-Kiukaanniemi, S., Jokelainen, J., Jokelainen, J., Auvinen, J., Auvinen, J., Puukka, K., Ruokonen, A., Jarvelin, M., Jarvelin, M., Jarvelin, M., Tapanainen, J., Tapanainen, J., Franks, S., Piltonen, T., & Morin-Papunen, L. (2017). Overweight and obese but not normal weight women with PCOS are at increased risk of Type 2 diabetes mellitus—a prospective, population-based cohort study. Human Reproduction, 32, 423–431. https://doi.org/10.1093/humrep/dew329.
(21) Wekker, V., Dammen, L., Dammen, L., Koning, A., Heida, K., Painter, R., Limpens, J., Laven, J., Lennep, J., Roseboom, T., & Hoek, A. (2020). Long-term cardiometabolic disease risk in women with PCOS: a systematic review and meta-analysis. Human Reproduction Update, 26, 942 – 960. https://doi.org/10.1093/humupd/dmaa029.
(22) Franczyk, B., Rysz, J., Ławiński, J., Rysz-Górzyńska, M., & Gluba-Brzózka, A. (2021). Is a High HDL-Cholesterol Level Always Beneficial?. Biomedicines, 9. https://doi.org/10.3390/biomedicines9091083.
(23) Tay, C., Mousa, A., Vyas, A., Pattuwage, L., Tehrani, F., & Teede, H. (2024). 2023 International Evidence‐Based Polycystic Ovary Syndrome Guideline Update: Insights From a Systematic Review and Meta‐Analysis on Elevated Clinical Cardiovascular Disease in Polycystic Ovary Syndrome. Journal of the American Heart Association: Cardiovascular and Cerebrovascular Disease, 13. https://doi.org/10.1161/jaha.123.033572.
(24) Aboeldalyl, S., James, C., Seyam, E., Ibrahim, E., Shawki, H., & Amer, S. (2021). The Role of Chronic Inflammation in Polycystic Ovarian Syndrome—A Systematic Review and Meta-Analysis. International Journal of Molecular Sciences, 22. https://doi.org/10.3390/ijms22052734.
(25) Murri, M., Luque‐Ramírez, M., Insenser, M., Ojeda-Ojeda, M., & Escobar-Morreale, H. (2013). Circulating markers of oxidative stress and polycystic ovary syndrome (PCOS): a systematic review and meta-analysis.. Human reproduction update, 19 3, 268-88 . https://doi.org/10.1093/humupd/dms059.
(26) Fiad, T., Cunningham, S., & Mckenna, T. (1996). Role of progesterone deficiency in the development of luteinizing hormone and androgen abnormalities in polycystic ovary syndrome.. European journal of endocrinology, 135 3, 335-9 . https://doi.org/10.1530/eje.0.1350335.
(27) Sha, T., Wang, X., Cheng, W., & Yan, Y. (2019). A meta-analysis of pregnancy-related outcomes and complications in women with polycystic ovary syndrome undergoing IVF.. Reproductive biomedicine online. https://doi.org/10.1016/j.rbmo.2019.03.203.
(28) Khomami, M., Shorakae, S., Hashemi, S., Harrison, C., Piltonen, T., Romualdi, D., Tay, C., Teede, H., Vanky, E., & Mousa, A. (2024). Systematic review and meta-analysis of pregnancy outcomes in women with polycystic ovary syndrome. Nature Communications, 15. https://doi.org/10.1038/s41467-024-49749-1.
(29) Yin, X., Ji, Y., Chan, C., & Chan, C. (2020). The mental health of women with polycystic ovary syndrome: a systematic review and meta-analysis. Archives of Women’s Mental Health, 24, 11-27. https://doi.org/10.1007/s00737-020-01043-x.
(30) Damone, A., Joham, A., Loxton, D., Earnest, A., Teede, H., & Moran, L. (2018). Depression, anxiety and perceived stress in women with and without PCOS: a community-based study. Psychological Medicine, 49, 1510 – 1520. https://doi.org/10.1017/s0033291718002076.
(31) Dybciak, P., Humeniuk, E., Raczkiewicz, D., Krakowiak, J., Wdowiak, A., & Bojar, I. (2022). Anxiety and Depression in Women with Polycystic Ovary Syndrome. Medicina, 58. https://doi.org/10.3390/medicina58070942.
(32) Davitadze, M., Malhotra, K., Khalil, H., Hebbar, M., Tay, C., Mousa, A., Teede, H., Brennan, L., Stener-Victorin, E., & Kempegowda, P. (2023). Body image concerns in women with polycystic ovary syndrome: A systematic review and meta-analysis.. European journal of endocrinology. https://doi.org/10.1093/ejendo/lvad110.
(33) Lindheim, L., Bashir, M., Münzker, J., Trummer, C., Zachhuber, V., Leber, B., Horvath, A., Pieber, T., Gorkiewicz, G., Stadlbauer, V., & Obermayer-Pietsch, B. (2017). Alterations in Gut Microbiome Composition and Barrier Function Are Associated with Reproductive and Metabolic Defects in Women with Polycystic Ovary Syndrome (PCOS): A Pilot Study. PLoS ONE, 12. https://doi.org/10.1371/journal.pone.0168390.
(34) Yurtdaş, G., & Akdevelioğlu, Y. (2019). A New Approach to Polycystic Ovary Syndrome: The Gut Microbiota. Journal of the American College of Nutrition, 39, 371 – 382. https://doi.org/10.1080/07315724.2019.1657515.
(35) Zhu, Q., & Zhang, N. (2024). Gut Microbiome Composition in Polycystic Ovary Syndrome Adult Women: A Systematic Review and Meta-analysis of Observational Studies. Reproductive Sciences, 31, 1800 – 1818. https://doi.org/10.1007/s43032-023-01440-4.
(36) Kukaev, E., Kirillova, E., Tokareva, A., Rimskaya, E., Starodubtseva, N., Chernukha, G., Priputnevich, T., Frankevich, V., & Sukhikh, G. (2024). Impact of Gut Microbiota and SCFAs in the Pathogenesis of PCOS and the Effect of Metformin Therapy. International Journal of Molecular Sciences, 25. https://doi.org/10.3390/ijms251910636.
(37) Liu, R., Zhang, C., Shi, Y., Zhang, F., Li, L., Wang, X., Ling, Y., Fu, H., Dong, W., Shen, J., Reeves, A., Greenberg, A. S., Zhao, L., Peng, Y., & Ding, X. (2017). Dysbiosis of Gut Microbiota Associated with Clinical Parameters in Polycystic Ovary Syndrome. Frontiers in microbiology, 8, 324. https://doi.org/10.3389/fmicb.2017.00324
(38) Li, P., Shuai, P., Shen, S., Zheng, H., Sun, P., Zhang, R., Lan, S., Lan, Z., Jayawardana, T., Yang, Y., Zhao, J., Liu, Y., Chen, X., El-Omar, E., & Wan, Z. (2023). Perturbations in gut microbiota composition in patients with polycystic ovary syndrome: a systematic review and meta-analysis. BMC Medicine, 21. https://doi.org/10.1186/s12916-023-02975-8.
(39) Banaszewska, B., Siakowska, M., Chudzicka-Strugała, I., Chang, R., Pawelczyk, L., Zwoździak, B., Spaczyński, R., & Duleba, A. (2020). Elevation of markers of endotoxemia in women with polycystic ovary syndrome.. Human reproduction. https://doi.org/10.1093/humrep/deaa194.
(40) Lele, P., Maiti, G., & Bajpai, S. (2021). P–623 Comparative preliminary study of LPS, hs CRP and gut bacterial flora of women to support dysbiosis of gut microbiota (DOGMA) as cause of PCOS. Human Reproduction. https://doi.org/10.1093/humrep/deab130.622.
(41) Zhu, Q., Zhou, H., Zhang, A., Gao, R., Yang, S., Zhao, C., Wang, Y., Hu, J., Goswami, R., Gong, L., & Li, Q. (2016). Serum LBP Is Associated with Insulin Resistance in Women with PCOS. PLoS ONE, 11. https://doi.org/10.1371/journal.pone.0145337.
(42) Xing, N., Ren, F., & Yang, H. (2024). Effects of ketogenic diet on weight loss parameters among obese or overweight patients with polycystic ovary syndrome: a systematic review and meta-analysis of randomized controlled trails. Food & Nutrition Research, 68. https://doi.org/10.29219/fnr.v68.9835.
(43) Cannarella, R., Rubulotta, M., Leonardi, A., Crafa, A., Calvo, A., Barbagallo, F., La Vignera, S., & Calogero, A. (2025). Effects of ketogenic diets on polycystic ovary syndrome: a systematic review and meta-analysis. Reproductive Biology and Endocrinology : RB&E, 23. https://doi.org/10.1186/s12958-025-01411-1.
(44) Sharifi, M., Saber, A., Moludi, J., Salimi, Y., & Jahan-Mihan, A. (2024). The effects of portfolio moderate-carbohydrate and ketogenic diets on anthropometric indices, metabolic status, and hormonal levels in overweight or obese women with polycystic ovary syndrome: a randomized controlled trial. Nutrition journal, 23(1), 152. https://doi.org/10.1186/s12937-024-01056-7
(45) Cincione, I. R., Graziadio, C., Marino, F., Vetrani, C., Losavio, F., Savastano, S., Colao, A., & Laudisio, D. (2023). Short-time effects of ketogenic diet or modestly hypocaloric Mediterranean diet on overweight and obese women with polycystic ovary syndrome. Journal of endocrinological investigation, 46(4), 769–777. https://doi.org/10.1007/s40618-022-01943-y
(46) Masood, I., Noreen, S., Raza, K., Khalid, W., Rahim, M., & Mohamedahmed, K. (2023). Effect of ketogenic diet and hypocaloric Mediterranean diet on metabolic and endocrine parameter in women suffering from Polycystic Ovary Syndrome. International Journal of Food Properties, 26, 3187 – 3196. https://doi.org/10.1080/10942912.2023.2275528.
(47) Mei, S., Ding, J., Wang, K., Ni, Z., & Yu, J. (2022). Mediterranean Diet Combined With a Low-Carbohydrate Dietary Pattern in the Treatment of Overweight Polycystic Ovary Syndrome Patients. Frontiers in nutrition, 9, 876620. https://doi.org/10.3389/fnut.2022.876620
(48) Shishehgar, F., Tehrani, F., Mirmiran, P., Hajian, S., Baghestani, A., & Moslehi, N. (2016). Comparison of Dietary Intake between Polycystic Ovary Syndrome Women and Controls. Global Journal of Health Science, 8, 302 – 311. https://doi.org/10.5539/gjhs.v8n9p302.
(49) Irmak, E., Sanlier, N., & Şanlıer, N. (2024). Could polyphenols be an effective treatment in the management of polycystic ovary syndrome?. International journal for vitamin and nutrition research. Internationale Zeitschrift fur Vitamin- und Ernahrungsforschung. Journal international de vitaminologie et de nutrition. https://doi.org/10.1024/0300-9831/a000802.
(50) Chavez, G., Jaworsky, K., & Basu, A. (2023). The Effects of Plant-Derived Phytochemical Compounds and Phytochemical-Rich Diets on Females with Polycystic Ovarian Syndrome: A Scoping Review of Clinical Trials. International Journal of Environmental Research and Public Health, 20. https://doi.org/10.3390/ijerph20156534.
(51) Tomova, A., Bukovský, I., Rembert, E., Yonas, W., Alwarith, J., Barnard, N., & Kahleová, H. (2019). The Effects of Vegetarian and Vegan Diets on Gut Microbiota. Frontiers in Nutrition, 6. https://doi.org/10.3389/fnut.2019.00047.
(52) He, F., & Li, Y. (2020). Role of gut microbiota in the development of insulin resistance and the mechanism underlying polycystic ovary syndrome: a review. Journal of Ovarian Research, 13. https://doi.org/10.1186/s13048-020-00670-3.
(53) Giampaolino, P., Foreste, V., Di Filippo, C., Gallo, A., Mercorio, A., Serafino, P., Improda, F., Verrazzo, P., Zara, G., Buonfantino, C., Borgo, M., Riemma, G., Angelis, C., Zizolfi, B., Bifulco, G., & Della Corte, L. (2021). Microbiome and PCOS: State-of-Art and Future Aspects. International Journal of Molecular Sciences, 22. https://doi.org/10.3390/ijms22042048.
(54) Qi, X., Yun, C., Sun, L., Xia, J., Wu, Q., Wang, Y., Wang, L., Zhang, Y., Liang, X., Wang, L., Gonzalez, F., Patterson, A., Liu, H., Mu, L., Zhou, Z., Zhao, Y., Li, R., Liu, P., Zhong, C., Pang, Y., Jiang, C., & Qiao, J. (2019). Gut microbiota–bile acid–interleukin-22 axis orchestrates polycystic ovary syndrome. Nature Medicine, 25, 1225 – 1233. https://doi.org/10.1038/s41591-019-0509-0.
(55) Kavyani, Z., Musazadeh, V., Fathi, S., Faghfouri, A., Dehghan, P., & Sarmadi, B. (2022). Efficacy of the omega-3 fatty acids supplementation on inflammatory biomarkers: An umbrella meta-analysis.. International immunopharmacology, 111, 109104 . https://doi.org/10.1016/j.intimp.2022.109104.
(56) Lu, L., Li, X., Lv, L., Xu, Y., Wu, B., & Huang, C. (2022). Associations between omega-3 fatty acids and insulin resistance and body composition in women with polycystic ovary syndrome. Frontiers in Nutrition, 9. https://doi.org/10.3389/fnut.2022.1016943.
(57) González, F., Considine, R., Abdelhadi, O., & Acton, A. (2019). Oxidative stress in response to saturated fat ingestion is linked to insulin resistance and hyperandrogenism in PCOS.. The Journal of clinical endocrinology and metabolism. https://doi.org/10.1210/jc.2019-00987.
(58) Yuan, J., Wen, X., & Jia, M. (2021). Efficacy of omega-3 polyunsaturated fatty acids on hormones, oxidative stress, and inflammatory parameters among polycystic ovary syndrome: a systematic review and meta-analysis.. Annals of palliative medicine, 10 8, 8991-9001 . https://doi.org/10.21037/apm-21-2018.
(59) Melo, V., Silva, T., Silva, T., Freitas, J., Sacramento, J., Vazquez, M., & Araújo, E. (2022). Omega-3 supplementation in the treatment of polycystic ovary syndrome (PCOS) – a review of clinical trials and cohort. Endocrine Regulations, 56, 66 – 79. https://doi.org/10.2478/enr-2022-0008.
(60) Obi-Ezeani, C., Onyegbule, O., Meludu, S., Dioka, C., Okwara, J., Njoku, C., & Onah, E. (2022). Effect of omega-3 supplementation on serum adiponectin and fertility hormones in women with polycystic ovarian syndrome. Journal of Applied Sciences and Clinical Practice. https://doi.org/10.4103/jascp.jascp_8_22.
(61) Albardan, L., Platat, C., & Kalupahana, N. (2024). Role of Omega-3 Fatty Acids in Improving Metabolic Dysfunctions in Polycystic Ovary Syndrome. Nutrients, 16. https://doi.org/10.3390/nu16172961.
(62) Allaire, J., Couture, P., Leclerc, M., Charest, A., Marin, J., Lépine, M., Talbot, D., Tchernof, A., & Lamarche, B. (2016). A randomized, crossover, head-to-head comparison of eicosapentaenoic acid and docosahexaenoic acid supplementation to reduce inflammation markers in men and women: the Comparing EPA to DHA (ComparED) Study.. The American journal of clinical nutrition, 104 2, 280-7 . https://doi.org/10.3945/ajcn.116.131896.
(63) So, J., Wu, D., Lichtenstein, A., Tai, A., Matthan, N., Maddipati, K., & Lamon-Fava, S. (2020). EPA and DHA differentially modulate monocyte inflammatory response in subjects with chronic inflammation in part via plasma specialized pro-resolving lipid mediators: A randomized, double-blind, crossover study.. Atherosclerosis. https://doi.org/10.1016/j.atherosclerosis.2020.11.018.
(64) Liao, Y., Xie, B., Zhang, H., He, Q., Guo, L., Subramanieapillai, M., Fan, B., Lu, C., & McIntyre, R. S. (2019). Efficacy of omega-3 PUFAs in depression: A meta-analysis. Translational psychiatry, 9(1), 190. https://doi.org/10.1038/s41398-019-0515-5
(65) Menichini, D., & Facchinetti, F. (2020). Effects of vitamin D supplementation in women with polycystic ovary syndrome: a review. Gynecological Endocrinology, 36, 1 – 5. https://doi.org/10.1080/09513590.2019.1625881.
(66) Tóth, B., Takács, I., Valkusz, Z., Jakab, A., Fülöp, Z., Kádár, K., Putz, Z., Kósa, J., & Lakatos, P. (2025). Effects of Vitamin D3 Treatment on Polycystic Ovary Symptoms: A Prospective Double-Blind Two-Phase Randomized Controlled Clinical Trial. Nutrients, 17. https://doi.org/10.3390/nu17071246.
(67) Łagowska, K., Bajerska, J., & Jamka, M. (2018). The Role of Vitamin D Oral Supplementation in Insulin Resistance in Women with Polycystic Ovary Syndrome: A Systematic Review and Meta-Analysis of Randomized Controlled Trials. Nutrients, 10. https://doi.org/10.3390/nu10111637.
(68) Miao, C., Fang, X., Chen, Y., & Zhang, Q. (2020). Effect of vitamin D supplementation on polycystic ovary syndrome: A meta-analysis. Experimental and Therapeutic Medicine, 19, 2641 – 2649. https://doi.org/10.3892/etm.2020.8525.
(69) Li, Y., Tan, Y., Xia, G., & Shuai, J. (2023). Effects of probiotics, prebiotics, and synbiotics on polycystic ovary syndrome: a systematic review and meta-analysis. Critical reviews in food science and nutrition, 63(4), 522–538. https://doi.org/10.1080/10408398.2021.1951155
(70) Zhang, J., Sun, Z., Jiang, S., Bai, X., , C., Peng, Q., Chen, K., Chang, H., Fang, T., & Zhang, H. (2019). Probiotic Bifidobacterium lactis V9 Regulates the Secretion of Sex Hormones in Polycystic Ovary Syndrome Patients through the Gut-Brain Axis. mSystems, 4. https://doi.org/10.1128/msystems.00017-19.
(71) Szydłowska, I., Nawrocka-Rutkowska, J., Gorzko, A., Pawłowski, H., Starczewski, A., & Szczuko, M. (2025). Changes in Hormonal Profile and Body Mass Index in Women with Polycystic Ovary Syndrome After Probiotic Intake: A 12-Week Placebo-Controlled and Randomized Clinical Study. Nutrients, 17. https://doi.org/10.3390/nu17030405.
(72) Chudzicka-Strugała, I., Kubiak, A., Banaszewska, B., Wysocka, E., Zwoździak, B., Siakowska, M., Pawelczyk, L., & Duleba, A. (2024). Six-month randomized, placebo controlled trial of synbiotic supplementation in women with polycystic ovary syndrome undergoing lifestyle modifications. Archives of Gynecology and Obstetrics, 311, 499 – 506. https://doi.org/10.1007/s00404-024-07833-3.
(73) Angoorani, P., Ejtahed, H., Marvasti, F., Taghavi, M., Ahranjani, B., Hasani-Ranjbar, S., & Larijani, B. (2023). The effects of probiotics, prebiotics, and synbiotics on polycystic ovarian syndrome: an overview of systematic reviews. Frontiers in Medicine, 10. https://doi.org/10.3389/fmed.2023.1141355.
(74) Zhang, T., He, Q., Xiu, H., Zhang, Z., Liu, Y., Chen, Z., & Hu, H. (2023). Efficacy and Safety of Coenzyme Q10 Supplementation in the Treatment of Polycystic Ovary Syndrome: a Systematic Review and Meta-analysis. Reproductive sciences (Thousand Oaks, Calif.), 30(4), 1033–1048. https://doi.org/10.1007/s43032-022-01038-2
(75) Karamali, M., & Gholizadeh, M. (2021). The effects of coenzyme Q10 supplementation on metabolic profiles and parameters of mental health in women with polycystic ovary syndrome. Gynecological Endocrinology, 38, 45 – 49. https://doi.org/10.1080/09513590.2021.1991910.
(76) Taghizadeh, S., Izadi, A., Shirazi, S., Parizad, M., & Gargari, B. (2020). The effect of coenzyme Q10 supplementation on inflammatory and endothelial dysfunction markers in overweight/obese polycystic ovary syndrome patients. Gynecological Endocrinology, 37, 26 – 30. https://doi.org/10.1080/09513590.2020.1779689.
(77) Nasiadek, M., Stragierowicz, J., Klimczak, M., & Kilanowicz, A. (2020). The Role of Zinc in Selected Female Reproductive System Disorders. Nutrients, 12. https://doi.org/10.3390/nu12082464.
(78) Unfer, V., Facchinetti, F., Orrù, B., Giordani, B., & Nestler, J. (2017). Myo-inositol effects in women with PCOS: a meta-analysis of randomized controlled trials. Endocrine Connections, 6, 647 – 658. https://doi.org/10.1530/ec-17-0243.
(79) P, M., P, M., Manivannan, A., Thangaraj, P., & M, L. (2024). The Effectiveness of Myo-Inositol in Women With Polycystic Ovary Syndrome: A Prospective Clinical Study. Cureus, 16. https://doi.org/10.7759/cureus.53951.
(80) Pustotina, O., Myers, S., Unfer, V., & Rasulova, I. (2024). The Effects of Myo-Inositol and D-Chiro-Inositol in a Ratio 40:1 on Hormonal and Metabolic Profile in Women with Polycystic Ovary Syndrome Classified as Phenotype A by the Rotterdam Criteria and EMS-Type 1 by the EGOI Criteria. Gynecologic and Obstetric Investigation, 89, 131 – 139. https://doi.org/10.1159/000536163.
(81) Artini, P., Di Berardino, O., Papini, F., Genazzani, A., Simi, G., Ruggiero, M., & Cela, V. (2013). Endocrine and clinical effects of myo-inositol administration in polycystic ovary syndrome. A randomized study. Gynecological Endocrinology, 29, 375 – 379. https://doi.org/10.3109/09513590.2012.743020.
(82) Sigue, R., & Decena, D. (2022). Efficacy of Myo-inositol in Improving Pregnancy Rate and Regulation of Menstrual Cycle for Patients With Polycystic Ovarian Syndrome: A Systematic Review and Meta-Analysis. Journal of Medicine, University of Santo Tomas. https://doi.org/10.35460/2546-1621.2021-0141.
(83) Jafar, N., Bennett, C., Moran, L., & Mansfield, D. (2023). Beyond Counting Sheep: Exploring the Link between Polycystic Ovary Syndrome and Sleep Health. Seminars in Reproductive Medicine, 41, 045 – 058. https://doi.org/10.1055/s-0043-1777724.
(84) Sun, J., Fang, D., Wang, Z., & Liu, Y. (2023). Sleep Deprivation and Gut Microbiota Dysbiosis: Current Understandings and Implications. International Journal of Molecular Sciences, 24. https://doi.org/10.3390/ijms24119603.
(85) Sondrup, N., Termannsen, A., Eriksen, J., Hjorth, M., Færch, K., Klingenberg, L., & Quist, J. (2022). Effects of sleep manipulation on markers of insulin sensitivity: A systematic review and meta-analysis of randomized controlled trials.. Sleep medicine reviews, 62, 101594 . https://doi.org/10.1016/j.smrv.2022.101594.
(86) Wang, L., Liu, K., Wang, G., & Yang, L. (2025). Effects of Exercise Interventions on Women With Polycystic Ovary Syndrome: A Systematic Review and Meta‐Analysis. Nursing & Health Sciences, 27. https://doi.org/10.1111/nhs.70209.
(87) Shele, G., Genkil, J., & Speelman, D. (2020). A Systematic Review of the Effects of Exercise on Hormones in Women with Polycystic Ovary Syndrome. Journal of Functional Morphology and Kinesiology, 5. https://doi.org/10.3390/jfmk5020035.
(88) Almenning, I., Rieber-Mohn, A., Lundgren, K., Løvvik, T., Garnæs, K., & Moholdt, T. (2015). Effects of High Intensity Interval Training and Strength Training on Metabolic, Cardiovascular and Hormonal Outcomes in Women with Polycystic Ovary Syndrome: A Pilot Study. PLoS ONE, 10. https://doi.org/10.1371/journal.pone.0138793.